Tesi
|
Università degli Studi di Roma "La Sapienza" |
| A Linus per il pinguino, a Richard per lo Gnu, e a tutti gli amici che fanno volare alti i gabbiani. |
Trasmissione del calore nei sitemi biologici
Introduzione
Lo studio da parte della medicina e della biologia del fenomeno complesso della vita ha messo in luce come sia strettamente legata alle condizioni termiche in cui essa opera. Le reazioni chimiche stesse sono influenzate dalla temperatura a cui avvengono (legge di Van't Hoff), e la vita non può esistere se non in un suo limitato campo. L'uomo stesso deve riuscire a smaltire la dovuta quantità di calore, o viceversa, a produrre quella necessaria nell'ambiente e nelle condizioni in cui opera, altrimenti la sua salute è in pericolo.
Precedenti studi hanno mostrato come gli animali pecilotermi, cioè a sangue freddo, incrementino le reazioni metaboliche all'aumentare della temperatura; la stessa correlazione può essere dimostrata per gli esseri omeotermi, comunemente chiamati a sangue caldo, anche se in maniera più difficoltosa, poiché in questi ultimi sussiste oltre al sistema posseduto dai pecilotermi anche un altro che si somma al fine di evitare brusche variazioni di temperatura nell'organismo, ma che può essere annullato con opportune dosi di anestetico (v. Fig. 1).
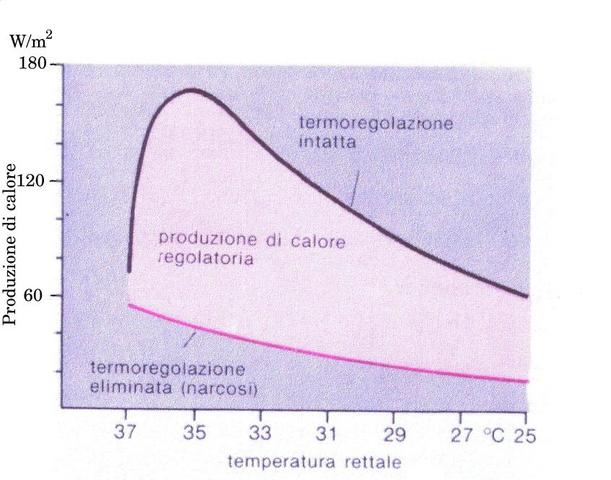
Fig. 1 Produzione di calore sviluppato da un organismo anestetizzato e da uno sveglio.
L'intervallo in cui un mammifero è in equilibrio termico con l'esterno risulta essere tra 36 °C e 39 °C, al di sotto della temperatura inferiore tende a produrre calore per attività volontaria dell'apparato locomotore, attività muscolare involontaria tonica o ritmica, aumento dei processi metabolici. Mentre se si superano 39 °C un organismo omeotermo non riduce il proprio metabolismo ma aggiunge un meccanismo di cessione del calore per evaporazione. Questa asimmetria non è l'unica a complicare lo studio sulla trasmissione del calore negli organismi biologici; la mappa termica del corpo umano mostra che siamo formati da un "involucro corporeo pecilotermo" e un "nucleo corporeo omeotermo" (v. Fig. 2). Inoltre ogni organismo sufficientemente evoluto è composto da tessuti differenti pressati l'uno sull'altro, e quindi oltre a non esserci né isotropia né omogeneità, nel caso di esperimenti bisogna attendere tempi dell'ordine della mezz'ora per raggiungere l'equilibrio.
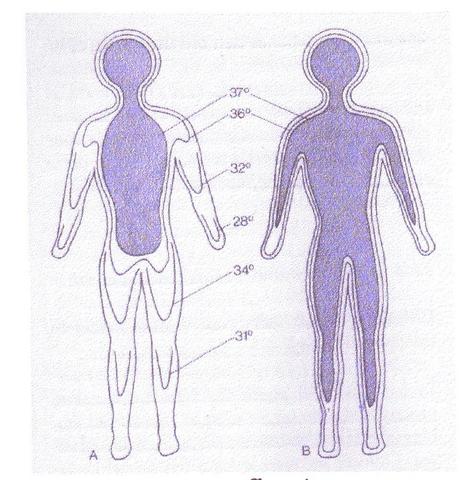
Fig. 2 A sinistra il nucleo omeotermo, a destra l'involucro pecilotermo
Un altro fattore importante da tenere presente prima di affrontare lo studio sulla trasmissione del calore riguarda le fluttuazioni giornaliere naturali degli organismi viventi, queste fluttuazioni non sono dovute all'alternarsi del giorno e della notte, ma si sincronizzano con esse, poiché avvengono anche in assenza di riferimenti esterni. Questo ritmo endogeno dell'organismo prende il nome di ritmo circadiano ed è sempre compreso tra le 24 e le 25 ore, anche in totale assenza di variazione dell'ambiente esterno: ad esempio in una stanza costantemente illuminata e mantenuta sempre alla stessa temperatura. Accanto a questa variazione vanno sommate anche quelle che riguardano periodi più lunghi come, per esempio, il ciclo mestruale.
Lo studio della propagazione del calore è di notevole importanza nella medicina; infatti, l'eccessivo calore sviluppato all'interno degli organi da particolari apparecchiature cliniche, come il radiografo o l'ecografo, può essere una causa di tumori. Inoltre si è osservata una stretta analogia tra la presenza di tumori e anomale mappe termiche.
Nella presente opera si analizzeranno inizialmente gli studi compiuti da Henry H. Pennes sulla produzione del calore all'interno dei tessuti umani, base di tutti gli attuali studi; successivamente le principali tecniche e studi svolti oggigiorno.
Risoluzione analitica dell'equazione del calore
Introduzione
Il primo studio compiuto sulla temperatura del sangue e dei tessuti è stato eseguito da Harry H. Pennes, analisi precedenti non si erano mai spinte oltre i 2,5 cm. Scopo della sua ricerca fu di riuscire a elaborare una formula analitica per ottenere una mappa termica dell'interno del corpo umano attraverso la teoria dei flussi di calore.
Metodologia
Le misure di temperatura sono state eseguite per mezzo dell'utilizzo di termocoppie. Il sistema galvanometrico aveva una sensibilità nominale di 0.75 µV/mm, la deflessione della scala a 1 metro di distanza, la resistenza di smorzamento critica di 49.0 Ω , periodo di 2 secondi e resistenza interna di 18.2 Ω. In opera la sensibilità è stata ridotta da una resistenza costituita da un filo di rame da 90.0 Ω in parallelo al galvanometro, questo provvedimento è stato preso, oltre che per regolare il galvanometro nel campo di misure appropriato, anche per aggiungere un leggero smorzamento al ritorno dell'indicatore quando veniva esclusa una termocoppia dal circuito. Il giunto di riferimento è stato sigillato in maniera permanente in una protezione a doppio strato sotto vuoto, e posto in un bagno di acqua a temperatura controllata. Indicazioni di un termometro posto nelle vicinanze del giunto hanno mostrato che non vi erano variazioni maggiori di 0.005 °C durante un periodo di 3-4 ore. La temperatura del giunto di riferimento era di 34.5 °C; per questi motivi le misure condotte dal giunto attivo potevano essere dedotte direttamente dalla lettura del galvanometro senza bisogno di compensare il circuito.
La termocoppia di riferimento utilizzata era Rame-Costantana di 0.813 mm di diametro, e di 135 cm di lunghezza. Mentre per il giunto attivo sono state usate quattro termocoppie. Tutte consistevano in cavi lunghi 90.0 cm con diametro di 0.0787 mm e del tipo Rame-Costantana, e sono state tutte isolate con l'applicazione di uno smalto commerciale.
Per la precisa esplorazione dei tessuti profondi è stato utilizzato un modello "Y". La giunzione è stata saldata in un punto con i due cavi collegati con un angolo che varia tra i 10° e i 20°; la lunghezza della giunzione non ha mai superato 0.20 mm. Una parte del ramo di rame è stata attaccata in maniera pulita alla giunzione. Le due braccia della Y sono state posate tese e fatte aderire l'una all'altra grazie all'applicazione, per la lunghezza di 10 cm, di un sottilissimo strato di vernice composto da una resina di bachelite; la giunzione è stata isolata attraverso l'applicazione della stessa vernice, ma la coda della Y (prolungamento della Costantana) elettricamente inattiva è stata lasciata inalterata. Successivamente la termocoppia è stata posta sotto tensione e la vernice si è cotta. La resistenza verso l'esterno del giunto misurava almeno 30 MΩ; questo valore era sufficiente a garantire un adeguato isolamento.
Le termocoppie ad aghi utilizzati per lo studio all'interno dei tessuti erano di acciaio inossidabile levigato e diametro pari a 0.404 mm.
Quella usata per la misura della temperatura rettale era costruita dentro un tubo di 2.5 cm di lunghezza. Tali misure sono state effettuate ad una profondità di 10.0-12.0 cm.
La termocoppia per la misura della temperatura dell'arteria brachiale è mostrata in Fig. 3; le temperature erano ritenute valide solamente se dopo l'estrazione dall'arteria l'ago estratto risultasse sufficientemente bagnato dal sangue.
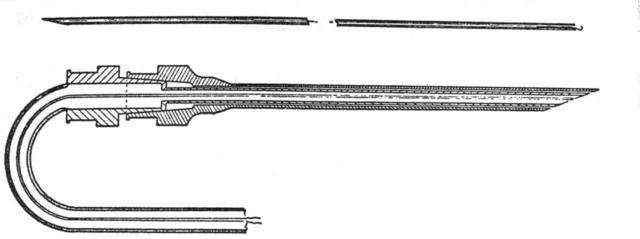
Fig. 3 In alto: ago in acciaio inossidabile da 0.404 mm di diametro per l'introduzione della termocoppia a Y. Questo ago è mostrato nell'avambraccio in Fig. 5A. In basso: termocoppia in acciaio inserita all'interno di un ago ipodermico da 0.5 mm con la termocoppia isolata sulla punta dell'ago. Preliminarmente la puntura viene effettuata con un ago da 0.912 mm con attaccata una siringa da 10cc; allo sgorgare del sangue all'interno della siringa, la siringa viene scollegata e montato l'ago da 0.511 mm che si inserisce perfettamente dentro quello da 0.912 mm. Tra una lettura e l'altra della temperatura l'ago da 0.511 mm viene estratto a sufficienza da far vedere il sangue fuoriuscire dall'ago da 0.912 mm. Nessuna anestesia è stata utilizzata per i pazienti.
Le resistenze di tutte le termocoppie si attestava a 100 ohm. Le curve di calibrazione sono state ritenute lineari, come appare dalla Fig. 4.
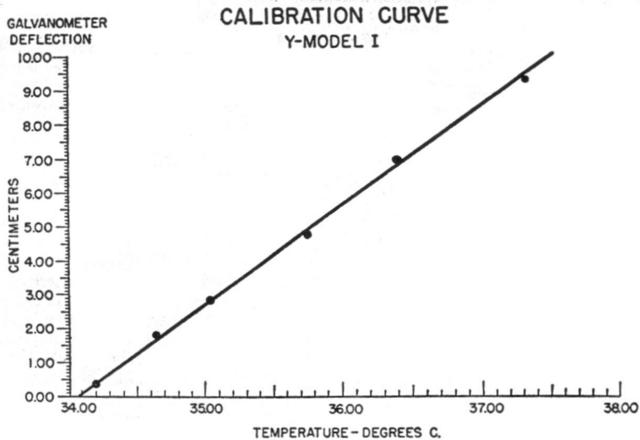
Fig. 4 Tipica curva di calibrazione, nel caso specifico della termocoppia a Y. Il coefficiente della temperatura in questo caso risulta essere 0.34 °C/cm.
La temperatura della pelle è stata misurata sia con l'ausilio delle termocoppie sia con una tecnica radiometrica. Il radiometro utilizzato era di tipo commerciale. Tutte le misure sono state fatte facendo un bilanciamento fra il sistema potenziometrico e la temperatura della stanza. Le temperature ottenute sono quindi accurate allo 0.1 °C. L'apertura interna del radiometro era di 3.65 cm, mentre quella esterna era pari ad un diametro di 4.75 cm.
I soggetti dell'esperimento erano tutti maschi appartenenti alla vasta popolazione dell'istituto neurologico della Columbia University. Nessuno di loro presentava malattie del sistema neuromuscolare periferico sia dal punto di vista clinico che per la natura dell'esperimento. Le analisi sono state condotte a partire dalle 9:00 del mattino, proseguendo per circa quattro ore; tutte condotte tra Maggio e Agosto. Le persone una volta entrate nella stanza dell'esperimento venivano spogliate e sdraiate sul lettino, potevano tenere un piccolo foglio di carta sulle anche e due cuscini sotto la testa e le spalle. La temperatura dell'aria e delle pareti era la stessa, inizialmente di 26°C e poteva salire per tutta la durata dell'esperimento al massimo di un grado centigrado. L'umidità, misurata da uno psicrometro variava tra il 45% e il 75%, ma mediamente si attestava intorno al 62%. Non vi erano correnti d'aria percepibili dai soggetti, e l'anemometro segnalava una velocità di 6.06 cm/s1.
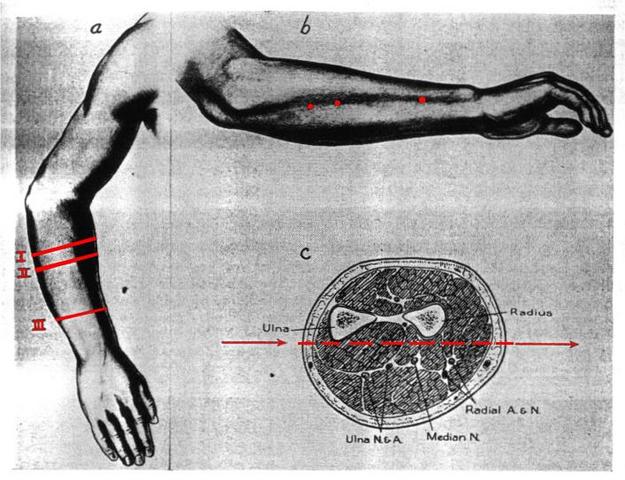
Fig. 5 Posizione del braccio destro durante l'esperimento. A) Vista dall'alto B) Vista laterale C) Sezione del braccio con relativa traiettoria
Tutte le letture sono state prese sul braccio destro come mostrato in Fig. 5. Tutti gli aghi e le termocoppie erano sterilizzati in autoclave a 120°C per 30 minuti, i cavi erano racchiusi in una guaina resistente al trattamento di sterilizzazione. Da notare che l'ago all'entrata e all'uscita dal braccio era pulito con alcol al 70%, e abbassava la temperatura della pelle nel punto di ben 4° e il ritorno alla normalità avveniva dopo 30-60 minuti. Conseguentemente a ciò la prima lettura avveniva dopo un'ora dall'inserzione dell'ago.
Nessun persona sottoposta all'esperimento ha affermato di sentire un dolore eccessivo, e questo perché il percorso dell'ago all'interno del braccio evitava accuratamente arterie e nervi; come si può ben notare dalla Fig. 5. Le lastre mostrate in Fig. 7 mostrano il passaggio dell'ago nel braccio. Per spostare la termocoppia all'interno del braccio si è utilizzato lo strumento di Fig. 6, che permetteva di bloccare il braccio e regolare sia la posizione della termocoppia che la tensione meccanica a cui erano sottoposti i fili.

Fig. 6 Fotografia del dispositivo per la regolazione della posizione della termocoppia. A) Base. B) Regolazione per la posizione lungo l'asse del braccio. C) Regolazione lungo l'asse verticale. D) Snodo indipendente per la regolazione del lato destro o sinistro. E) Vite senza fine. F) Dado G) Manopola zigrinata H) Indicatore di posizione I) Scala lineare (mm) metallica K) Barra orizzontale per la movimentazione dei cavi
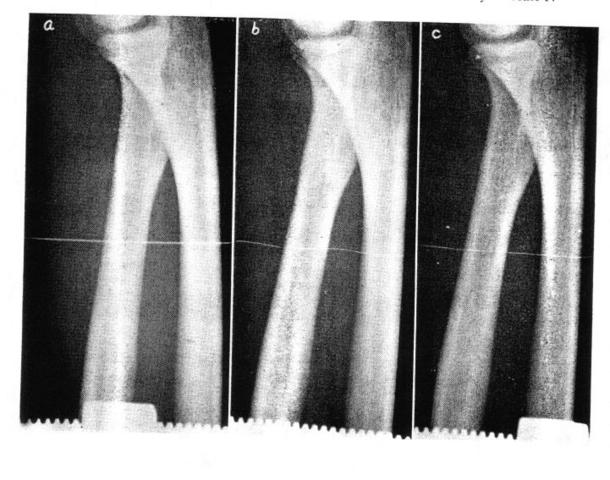
Fig. 7 Radiografie dell'avambraccio con i fili della termocoppia inseriti
Risultati sperimentali
Distribuzione della temperatura lungo l'asse delle estremità superiori
L'analisi delle temperature negli strati profondi sarebbe stata notevolmente semplificata se il gradiente di temperatura lungo l'asse maggiore fosse stato trascurabile. Per questo motivo sono state eseguite le misure della temperatura della pelle con il radiometro, i risultati sono esposti in Fig. 8 e Fig. 9. I valori ottenuti sono stati diagrammati in Fig. 10.
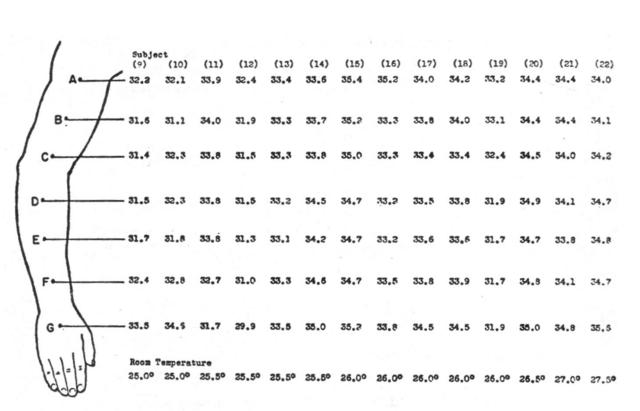
Fig. 8 Distribuzione delle temperature della pelle lungo l'asse maggiore del braccio, faccia superiore. I valori sono in gradi Celsius.
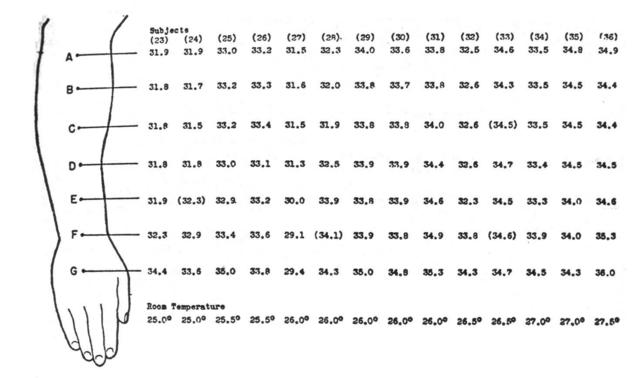
Fig. 9 Distribuzioni della temperatura cutanea dell'avambraccio, faccia superiore. I valori sono espressi in gradi Celsius.
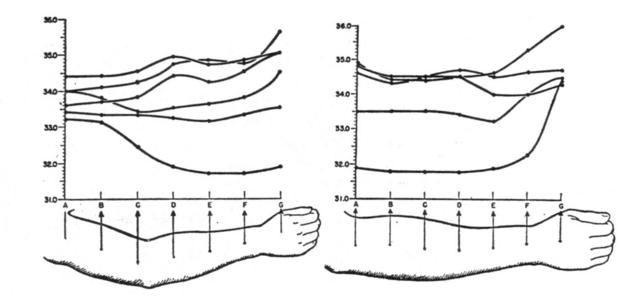
Fig. 10 Distruzioni della temperatura cutanea. A sinistra: distribuzione lungo tutto il braccio, da notare l'assenza di gradiente a metà dell'avambraccio. A destra: distribuzione lungo l'avambraccio, da notare l'assenza di gradiente in prossimità dell'avambraccio.
A circa un terzo dell'avambraccio, centrato tra D e E in Fig. 8, e circa in B in Fig. 9 (cfr.Fig. 10) il gradiente della temperatura risulta appiattito più che in ogni altra parte. Le maggiori differenze dal valore nel punto in questione sono, tralasciando se siano negative o positive (riferite a Fig. 9):
- A-B 0.2 °C
- B-C 0.1 °C
- C-D 0.2 °C
- D-E 0.4 °C
- E-F 0.4 °C
- F-G 0.8 °C
Poiché la distanza fra un punto e l'altro era di 5.0 cm, allora il gradiente tra A e B risulta di 0.04 °C/cm, e tra B e C di 0.02 °C/cm. Questi gradienti sono trascurabili rispetto al gradiente radiale della temperatura nel piano I (v. Fig. 5). Una brusca variazione dell'andamento delle temperature si ritrova vicino alle giunzioni prossimali e distali dell'avambraccio, con un ripido innalzamento tra il polso e la mano. L'uniformità di temperatura nel primo terzo dell'avambraccio può essere dovuta, molto probabilmente, alla maggiore uniformità della sezione del braccio, al contrario della parte distale dell'arto più appiattita e allungata.
Fondamentalmente sono stati trovati tre tipi di distribuzione per le temperature di tutto il braccio: una temperatura superiore nella parte distale o nella mano rispetto alla parte prossimale, in 8 soggetti; una temperatura più bassa in 4 soggetti; e una differenza trascurabile in 2 soggetti, circa ±0.1 °C. Similmente lo stesso tipo di distribuzione si ritrova nell'avambraccio: una temperatura distale più alta in 11, una più bassa in 2, ed un'uniforme temperatura in 1 soggetto.
Distribuzione della temperatura attorno la circonferenza dell'avambraccio
Una volta studiato il gradiente lungo una "faccia" del braccio e notato che esistono dei gradienti di temperatura, si è fatto lo stesso studio lungo le altre facce. Come si vede dalla Fig. 11, che rappresenta le misure effettuate su tre soggetti distinti, si ha generalmente lo stesso andamento della faccia superiore.
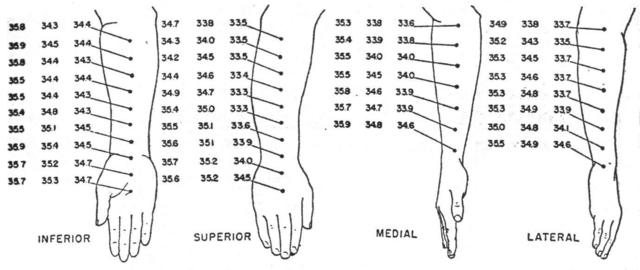
Fig. 11 Distribuzioni di temperatura lungo tutte e quattro le facce dell'avambraccio. Misure effettuate con il radiometro. Valori espressi in gradi Celsius.
Per postulare una simmetria cilindrica, che renderebbe la stesura delle equazioni più semplice, si è misurato attraverso il radiometro le temperature attorno al braccio lungo le sezioni I e III. Si sono presi dei punti a distanze che variano dai 1.0 cm ai 2.0 cm.
Condizioni isoterme non sono state mai trovate, esse variano in modo inimmaginabile da soggetto a soggetto, come si vede in tabella 1 e in Fig. 12. I massimi scostamenti si aggirano tra i 0.7 °C e i 2.6 °C, ma mediamente si attestano a 1.2 °C. Le più alte temperature sono state rilevate nel mezzo della faccia mediale in 12 soggetti su un campione di 17, 3 soggetti invece nel mezzo della faccia laterale, e infine 2 soggetti in entrambe le zone citate.
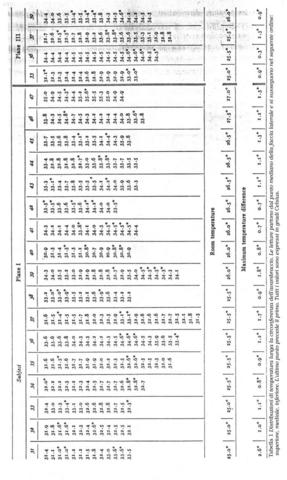
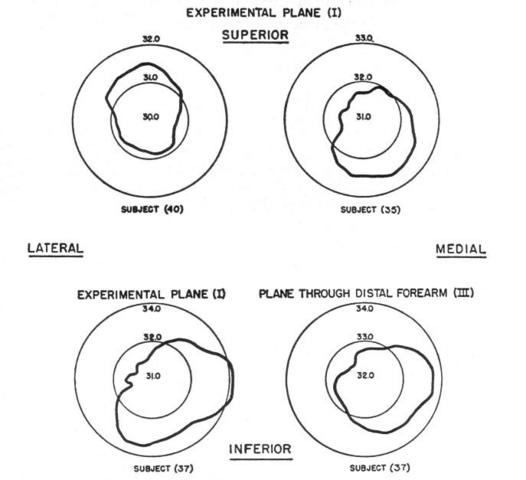
Fig. 12 Distribuzioni di temperatura nei piani I e III. Il soggetto 35 (subject 35) mostra la distribuzione più comune. Il soggetto 40 (subject 40) mostra la seconde più comune distribuzione. Mentre il soggetto 37 (subject 37) indica come possa esserci la stessa distribuzione sia nella sezione I che III.
Il motivo per cui si ritrova nella zona superiore-laterale un minimo delle temperature può essere dovuto alla presenza dell'ulna in prossimità della pelle, e che la parte mediale contiene tutto tessuto molle. Inoltre nello studio della III sezione si è visto che, poiché vi è il radio che occupa tutta la parte mediale, la distribuzione di temperature simile alla sezione I che ritroviamo è dovuta alla posizione più uniforme e simmetrica del tessuto molle. Lo stesso andamento tra sezione I e III si è ritrovato in tutti i soggetti tranne 1, escludendo asimmetrie delle ossa o del tessuto molle.
Tutti gli avambracci hanno le vene della vista laterale prominenti, che percorrono l'ulna dalla parte inferiore a quella posteriore prima di tuffarsi all'interno della parte inferiore-mediale del braccio. La faccia superiore dell'avambraccio di solito non contiene grosse vene, mentre le facce mediale e inferiore portano sempre un numero variabile ma cospicuo di canali venosi. Per questi motivi la maggior parte dei massimi di temperatura sulla faccia mediale sono dovuti alla densità di vene, comparata con la scarsa vascolarizzazione nella zona superiore-laterale [10].
Effetti dell'occlusione circolatoria sulla temperatura del braccio, dell'avambraccio e della mano
Le condizioni non isoterme che si ritrovano lungo gli arti superiori lasciano presupporre che siano dovute solamente ai diversi percorsi e portate dei vasi sanguigni. Quindi l'interruzione del flusso arterioso e venoso dovrebbe creare una variazione di questo campo e mostrare una dipendenza da questa variabile [11, 12].
Effetti dell'occlusione circolatoria sull'avambraccio, zona distale: interruzione del ritorno venoso
Questo esperimento, provato su 11 soggetti, ha prodotto i seguenti risultati:
- Cinque persone non hanno avuto cambiamenti significativi, tra gli ±0.1 °C, in tutte e tre le zone della pelle L, S e M (rispettivamente laterale, superiore e mediale) durante il periodo dell'occlusione; questo periodo durava dai 24 ai 40 minuti. Di queste:
- : due non hanno mostrato effetti dopo il ripristino della circolazione.
- uno ha avuto un innalzamento della temperatura in tutte e tre le aree.
- due hanno avuto un innalzamento in una o due aree, in L o in L e M.
- Cinque soggetti hanno avuto una diminuzione della temperatura in una o più zone durante l'arresto circolatorio. Di questi:
- due hanno avuto una diminuzione in L, S e M di 0.9 °C, 0.5 °C e 2.0 °C e 2.0 °C, 0.4 °C e 0.7 °C. Il periodo dell'occlusione è variato dai 36 ai 38 minuti. Dopo il rilascio della cuffia la temperatura è risalita molto velocemente, ma non ha raggiunto i valori che aveva precedentemente l'esperimento.
- due soggetti hanno avuto un abbassamento solo in M di 1.3 °C e 0.7 °C, in un periodo di occlusione pari rispettivamente a 30 e 32 minuti. Al rilascio la temperatura è risalita ai livelli originali, prima di tutti in M (v. Fig. 13 a sinistra).
- un soggetto ha mostrato un innalzamento della temperatura durante i 28 minuti di occlusione, esattamente di 0.5 °C in L, 0.3 °C in S e 0.3 °C in M (v. Fig. 13 a destra).
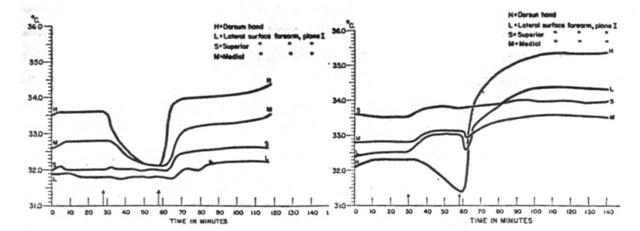
Fig. 13 A sinistra: risposta più comune all'occlusione circolatoria. A destra: risposta inusuale all'occlusione circolatoria
Durante l'occlusione la temperatura della mano è scesa progressivamente. Più alta era la temperatura della mano, più ripida era la curva della sua discesa. Se inizialmente la mano era in un campo tra i 34.0 °C e i 35.0 °C, l'abbassamento consisteva tra i 2.0 °C e i 2.6 °C per la durata di 24-40 minuti. Con mani a 32.0-34.0 °C l'abbassamento era di 0.6-0.9 °C; con una mano a 30.6 °C l'abbassamento era di 0.2 °C per un'occlusione di 23 minuti.
Tra i cinque soggetti che hanno avuto un abbassamento della temperatura in uno o più punti dell'avambraccio durante l'occlusione, il dorso della mano era di 0.2°, 0.5°, 0.7°, 0.7° e 1.0 °C più caldo della parte più calda nella sezione I. La Fig. 11 mostra che un dorso della mano relativamente caldo è accompagnato da una temperatura più alta di tutto l'avambraccio distale, se confrontato con l'avambraccio prossimale. Questo suggerisce che l'abbassamento di temperatura in questi cinque soggetti è dovuto alla rimozione della fonte di calore costituita dal ritorno venoso delle estremità distali. La mancanza di uniformità della risposta nei soggetti, per esempio l'innalzamento della temperatura dell'avambraccio durante l'occlusione, può essere considerata chiaramente come un disturbo dovuto ai cambiamenti di distribuzione del fluido oltre la cuffia, e alla variazione della portata in volume.
Dopo l'allentamento della cuffia, 8 degli 11 soggetti hanno mostrato una considerevole risalita della temperatura oltre i livelli di controllo in una o più aree; nessun soggetto ha mostrato una diminuzione di temperatura. La temperatura della mano è salita molto velocemente in tutti i soggetti dopo la rimmissione della circolazione, fino a superare i livelli precedenti; in generale più bassa era la temperatura prima della vasocostrizione, maggiore era il valore dell'incremento dopo il ripristino della circolazione. L'aumento della temperatura cutanea è senza dubbio dovuta a un maggiore volume di sangue fluente attraverso la pelle dalla mano e dall'avambraccio distale verso il centro del corpo: un chiaro caso di iperemia. Durante la prima parte di questo periodo, un rossore della pelle lungo la vena basilica era abbastanza marcato insieme ad un leggero rigonfiamento di questo vaso. Cambiamenti lungo la faccia superiore S, durante o dopo l'occlusione, o non sono avvenuti o sono stati di rilievo molto scarso se comparato alle facce L o M; questo fenomeno è correlato alla penuria di larghe vene dell'avambraccio.
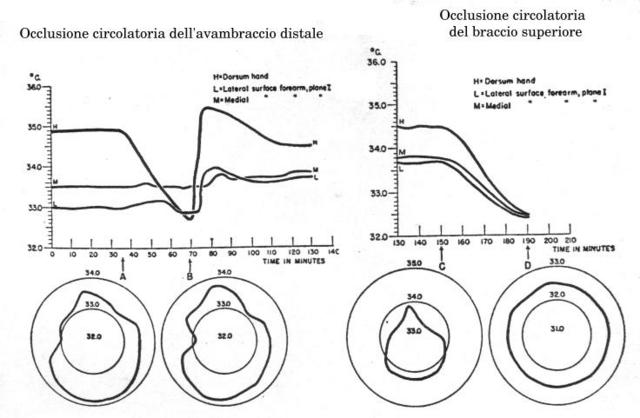
Fig. 14 Comparazione degli effetti dell'occlusione circolatoria nell'avambraccio distale e nel braccio superiore, nello stesso soggetto. Notare come ci siano pochissimi cambiamenti nella distribuzione della temperatura tra A e B alla fine dell'occlusione. Mentre nel braccio alla fine dell'occlusione abbiamo una situazione di isotermia.
Prima di allentare l'occlusione, la temperatura del piano I è stata rimisurata sull'intera circonferenza in tutti i soggetti. In soggetti che non hanno avuto modificazioni durante l'occlusione, le condizioni di non isotermicità non sono state modificate. In soggetti che hanno avuto una risposta la distribuzione di temperatura si è modificata con piccole riduzioni del massimo (0.2°-0.3 °C) nel piano I, ma non si è raggiunta un'uniforme temperatura (Fig. 14 a sinistra). Durante l'occlusione la cuffia è stata mantenuta da 5.0 a 7.0 cm dalla sezione I; perciò un piccolo flusso sanguigno nelle vene superficiali deve aver continuato a sussistere.
Effetti dell'occlusione circolatoria del braccio superiore: interruzione a livello del gomito di tutto il flusso attraverso l'avambraccio
I risultati sono stati totalmente identici in tre soggetti. Il primo effetto dell'arresto del sangue arterioso è stato un raffreddamento di tutte e tre le aree della sezione I e della mano, l'andamento iniziale del raffreddamento è stato più ripido nelle zone a temperatura più alta. Dopo la prolungata ischemia (35-40 minuti), misurazioni attorno l'intera circonferenza dell'avambraccio nella sezione I hanno mostrato uno stato di isotermia con uno scarto di ±0.1 °C (v. Fig. 14 a destra). Le risposte differenti tra l'area della vena basilica L e mediale M rispetto alla superiore S, suggerisce che il percorso delle vene sottocutanee sia un fattore determinante. Molto importante è il fatto che le reazioni di asimmetria tra osso e tessuto molle nell'avambraccio prossimale non abbiano assolutamente contrastato il conseguimento di una distribuzione isoterma radiale fin dai primi minuti dell'interruzione.
Alla fine dell'ostruzione per un tempo così lungo i soggetti hanno provato un dolore molto intenso, accompagnato poi da debolezza alle dita e al polso e con una marcata hypesthesia (assenza del tatto e del dolore) [13].
Paragone tra la temperatura del retto, dell'arteria brachiale e dell'interno dell'avambraccio
Nell'analisi dell'effetto del flusso sanguigno per la temperatura interna dell'avambraccio, descritte in fig.16 a, b e c, la conoscenza della temperatura del sangue dell'arteria brachiale all'altezza del gomito è fondamentale. Per determinare la massima temperatura dei tessuti sono state utilizzate tre termocoppie ad ago, inserite verticalmente sulla faccia superiore dell'avambraccio; una sull'asse centrale e le altre due a distanza di 0.5 cm da ambo i lati. Gli aghi sono stati fatti penetrare all'interno fino a raggiungere l'osso o fino a quando non veniva superato il massimo. Gli aghi laterali sono stati inseriti a 1.0 cm e 2.0 cm dall'asse centrale, ripetendo il procedimento tutte le volte.
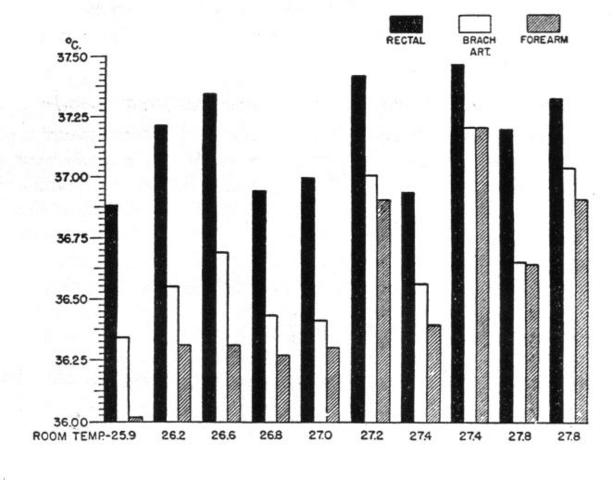
Fig. 15 Confronto della temperatura del retto, dell'arteria brachiale e all'interno dell'avambraccio in 10 soggetti.
La temperatura dell'arteria brachiale ha sempre uguagliato o superato la temperatura interna dell'avambraccio in tutti i soggetti (v. Fig. 15); le differenze si sono attestate tra 0.00° e 0.36 °C con una media di 0.16 °C. La temperatura media del sangue dell'arteria era di 36.68 °C, mentre la massima temperatura all'interno dell'avambraccio era di 36.52 °C. Il flusso dell'arteria verso il braccio funziona come un sistema di riscaldamento per i tessuti che si estende dalla pelle fino all'asse geometrico dell'arto [14]. Questo è un importante risultato perché nello studio della temperatura nei tessuti profondi dell'avambraccio il contributo della circolazione può essere ipotizzato, secondo Pennes, come un trasferimento di calore unidirezionale dal sangue al tessuto.
Distribuzione delle temperature all'interno dell'avambraccio prossimale lungo gli assi trasversali
La forma dei gradienti di temperatura attraverso gli assi trasversali per tutta la loro interezza è stata determinata con le termocoppie di tipo Y, con la tecnica descritta e illustrata in precedenza (cfr. cap.2 "Metodologia"). E' stato necessaria far trascorrere almeno un'ora tra l'inserzione della termocoppia e l'inizio delle letture.
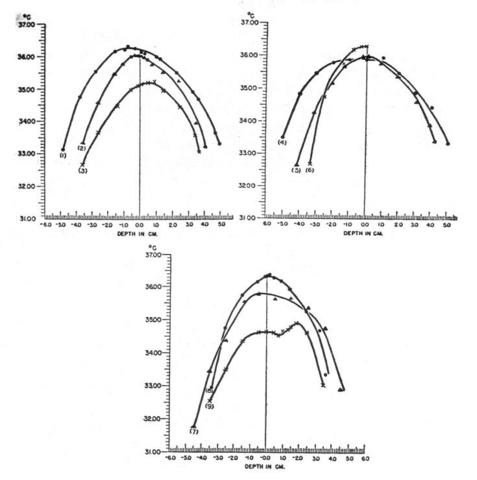
Fig. 16 Curve rappresentanti l'andamento delle temperature all'interno dell'avambraccio in 9 soggetti. La temperatura della stanza era per la curva: 1, 26.5 °C; 2, 26.6 °C; 3, 26.1 °C; 4, 26.7 °C; 5, 26.3 °C; 6, 27.4 °C; 7, 26.3 °C; 8, 26.7 °C; 9, 27.1 °C. I valori negativi si riferiscono al lato laterale, quelli positivi a quello mediale.
Con questo modello la temperatura della pelle non è stata determinata accuratamente, poiché l'asse più lungo della giunzione era orientato perpendicolarmente rispetto alla superficie della pelle: in questo modo era soggetta all'influenza dell'aria e della termocoppia stessa. Per questo motivo si è preferito misurare la temperatura della pelle nel punto d'inserzione e di uscita della termocoppia con il metodo radiometrico quando la termocoppia era momentaneamente staccata dai morsetti. Le letture all'interno del tessuto in un determinato punto sono state considerate valide se per la durata di due minuti la lettura aveva variazioni massime di ±0.05 °C. Se una lettura non riusciva a diventare stabile, era ripetuto tutto il procedimento fin dall'inizio, cioè dall'inserzione della termocoppia. Una volta che la termocoppia aveva analizzato tutto il percorso in un verso, fuoriuscendo dal braccio, venivano rifatte le stesse letture in verso opposto, facendo rientrare la termocoppia da dove era uscita. I grafici esposti in Fig. 16 riguardano soggetti le cui misurazioni in entrambi i versi di percorrenza sono coincise con un errore di ±0.1 °C. La coincidenza delle temperature in entrambi i versi di percorrenza è stata maggiore nel centro della sezione che nella zona periferica.
Le caratteristiche più significative di Fig. 16 sono :
- In tutti i casi la temperatura ha raggiunto il suo massimo vicino all'asse geometrico dell'arto
- Le curve non posseggono una simmetria circolare perfetta. Il massimo di temperatura era eccentrico rispetto all'asse dell'arto di una distanza variabile tra i 2.0 mm e i 10.0 mm, senza una possibilità di predizione. Poiché le circonferenze concentriche dell'arto non sono delle isoterme (cfr. paragrafo 3.2), ogni curva deve essere interpretata come distribuzione lungo solo quell'asse dell'esperimento; comunque può essere ipotizzata una simmetria non cilindrica, che ricalchi la distribuzione trovata in superficie.
- Le curve, con l'eccezione della 9, tendono a sovrapporsi verso il centro dell'arto. La temperatura dei tessuti, perciò, tende ad essere più uniforme centralmente che in periferia. La temperatura media è stata di 36.09 °C.
- La curva 9 mostra un comportamento bifasico, mostrando un massimo a 4.0 mm sul lato laterale e un secondo massimo a 1.9 cm sul lato mediale. Questa anormale distribuzione è dovuta senza dubbio a qualche variazione locale della vascolarizzazione.
Il percorso dell'ago in tutti i casi è stato selezionato per ottenere la massima distanza tra le arterie ulnare e radiale, ma la posizione del picco mediale nella curva 9 sembra corrispondere alla posizione dell'arteria radiale, confrontandola con la posizione orizzontale dall'asse.
Analisi
La curva media disegnata in Fig. 17 sarà ora analizzata applicando la teoria dei flussi di calore.
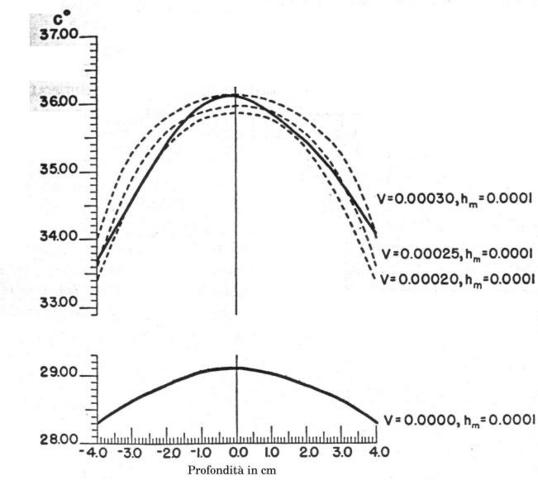
Fig. 17 Curva media sperimentale e curva teorica dell'andamento della temperatura all'interno dell'avambraccio.
I simboli utilizzati per la seguente trattazione sono definiti così:
θ = temperatura dei tessuti, °C
θa = temperatura del sangue arterioso, °C
θv = temperatura del sangue venoso, °C
r = normale alla superficie isotermica cilindrica (distanza radiale dall'asse), cm
R = raggio del cilindro, cm
K = conduttività termica specifica dei tessuti, espressa in ` (g*cal)/ (cm^3 * s * °C)`
E = costante di Newton per il raffreddamento espressa in ` (g*cal)/ (cm^2 * s * °C)`
hm = potenza del calore sviluppato dai tessuti, ` (cal)/ (cm^3 * s )`
hb = potenza trasferita dal sangue ai tessuti, ` (cal)/ (cm^3 * s )`
V = portata del sangue nei tessuti, ` (g)/ (cm^3 * s )`
s = calore specifico del sangue, ` (cal)/ (g * °C)`
Per la trattazione saranno assunte le seguenti ipotesi:
La sezione dell'avambraccio è molto simile ad una circonferenza, perciò le equazioni verranno espresse in coordinate cilindriche; in realtà la sezione dell'avambraccio è ellittica, con una differenza nella lunghezza tra i due assi di 0.5-1.0 cm.
I tessuti dell'avambraccio contengono due fonti di calore: il calore prodotto dal metabolismo dei tessuti e il calore trasferito dal sangue nei tessuti in ogni punto dell'arto. Per semplicità dell'analisi, la potenza prodotta dal tessuto sarà considerata costante per tutto l'avambraccio. Il valore da scegliere è tra 2.64 e 2.74 ` (cal) / (cm^3 * s) `, cioè dell'ordine di grandezza dei processi biochimici o vitali [17]. Inoltre, poiché la produzione di calore vicino la superficie esterna è minore rispetto a quella al centro dell'avambraccio, la potenza sviluppata dalla pelle e dal tessuto adiposo sottocutaneo, sarà considerato di un ordine di grandezza inferiore. La presenza dell'ulna e del radio, nel quadrante superiore-laterale, dovrebbe disturbare il gradiente di temperatura, se la produzione di calore di queste zone differisse da quella di altri tessuti. Ma siccome i due diagrammi di Fig. 17 hanno lo stesso andamento, il loro effetto non è evidente: perciò essi verranno considerati matematicamente come se trattasse di tessuto molle.
In assenza di evidenza del contrario, la portata in volume di sangue per unità di volume sarà ritenuta costante attraverso tutto l'avambraccio. La potenza trasferita dal sangue al braccio non può ovviamente essere considerata uniforme. Partendo dal principio di Fick:
| ` h_b = V s (theta_a - theta_v) ` | (1) |
θv, la temperatura del sangue venoso che lascia il tessuto nel punto, deve essere funzione della temperatura del tessuto nel punto. Non sono disponibili dati sulle relazioni dell'equilibrio termico dei capillari e il tessuto intorno; presumibilmente le condizioni fisiche della circolazione dei capillari favoriscono un equilibrio completo. Dopo l'introduzione di una costante d'equilibrio, k, che è assunta uniforme attraverso tutto il tessuto:
| ` theta_nu = theta + K (theta_a - theta) ` , con `0.0 <= K <= 1.0` | (2) |
Sostituendo nell'equazione 1:
| ` h_b = V s (K-1) (theta - theta_a) ` | (3) |
L'equazione 3 afferma che la potenza trasferita dal sangue ai tessuti in ogni punto è proporzionale alla differenza tra la temperatura del sangue arterioso e dei tessuti nel punto, poiché V s (k-1) è costante per stati quasi stazionari. θa è considerato uniforme attraverso il tessuto; l'introduzione di una temperatura media del sangue nei capillari, benché fisicamente evidente, rende l'analisi incapace di essere verificata con mezzi sperimentali. Comunque, considerando l'equilibrio termico tra capillari e tessuto il più completo possibile, la costante k tende al suo valore limite, cioè 1. Quindi l'equazione 3 si riduce a:
| `h_b = V s (theta_a - theta) ` | (4) |
La conduttività specifica K sarà considerata uniforme attraverso tutto l'avambraccio. In realtà questo è parzialmente vero, poiché alcune parti dell'osso arrivano a 1.7 volte la conducibilità del muscolo, fortunatamente questo valore è comunque molto basso ` (0.0005 (g * cal) / (cm^3 * s * °C)) ` e quindi commettiamo un piccolo errore [17, 18, 19, 20].
La legge di Newton sul raffreddamento dei corpi sarà applicata nei riguardi dello scambio termico tra pelle e ambiente esterno. La perdita di calore per conduzione sarà considerata trascurabile, poiché l'avambraccio in questo studio è stato avvolto completamente solo dall'aria, eccetto per gli appoggi del gomito e della mano. Siccome le variazioni climatiche all'interno della stanza degli esperimenti sono state minime, la legge di raffreddamento sarà applicata non considerando un'ampia gamma di fattori dell'ambiente, ma solo le condizioni sperimentali. Il valore del coefficiente di raffreddamento sarà preso pari a 0.0001 ` (g * cal) / (cm^3 * s * °C) ` [18], e il calore perso per evaporazione del sudore sarà considerato pari al 21% del tutto il calore fuoriuscente dall'arto.
L'equazione differenziale del calore in coordinate cilindriche è la seguente:
| ` rho c_p (d theta) / (d t) = K [(d^2 theta) / (d r^2 )+ 1/r (d theta)/(d r) + 1/r^2 (d theta)/(d Phi) + (d^2 theta)/(d Z^2)] + h_m + h_b ` | (5) |
Poiché scriviamo questa equazione per uno stato quasi stazionario, il termine a sinistra dell'equazione, dipendente dal tempo, diviene zero. E' stato mostrato come il gradiente lungo l'asse dell'avambraccio sia trascurabile (cfr. Cap.1.3.1), questo porta a porre il termine ` (d^2 theta) / (d Z^2) ` uguale a zero; approssimando una simmetria cilindrica anche il gradiente angolare ` (d theta)/(d Phi)` diviene zero. L'equazione da risolvere diviene allora:
| ` -K [(d^2 theta)/(d r^2) + 1/r (d theta)/(d r) ]=h_m+h_b` | (6) |
| ` (d^2 theta)/(d r^2) + 1/r (d theta)/(d r) + (h_m+h_b) / K = 0` | (6a) |
La 6 e' un'equazione differenziale del secondo ordine, se sia hm sia hb sono uniformi lungo tutto il cilindro. Quindi la distribuzione di temperatura si puo' ottenere con i seguenti passaggi:
| ` theta (r) = theta_0 - (h_m+h_b)/(4K) r^2 + theta_1 log (r)` | (6b) |
| ` theta (r) = theta_0 - (h_m+h_b)/(4K) r^2` | (7a) |
| ` theta (r) = [ theta_a - (h_m+h_b)/(4K) R^2] - (h_m+h_b)/(4K) r^2 ` | (7b) |
Il primo passaggio è da intendersi considerando la condizione al bordo θ uguale alla temperatura sull'asse, mentre il secondo si ottiene imponendo come condizione al bordo θa uguale alla temperatura sulla superficie del cilindro. La 7b e' la soluzione generale, ma poiché hb è data dall'equazione 3 come una funzione di θ, l'equazione differenziale da risolvere diventa:
| ` (d^2 theta) / (d r^2) + 1/r (d theta)/(d r) + a theta = b ` | (8) |
con:
- ` a = (V s (K-1))/K `
- ` b=V s ((K-1) theta_a - h_m)/K `
L'equazione 8 rappresenta una funzione di Bessel2 di ordine zero, dove a e b sono costanti negative. Una soluzione fisica di questa equazione, dopo aver messo appropriate condizione al contorno, è:
| ` theta (r) = ((theta_s - b/a)J_0 (i sqrt(|a|)r)+ b/a)/(J_0(i sqrt(|a|)R)) ` | (9) |
Dove J03 rappresenta una funzione di Bessel di variabile immaginaria, di ordine zero e di primo tipo, ` i=sqrt(-1) `. La legge di Newton sul raffreddamento afferma che:
| ` -K (d theta)/(d r) = E (theta_a - theta_E)` | (10) |
Dove con θE si indica la temperatura esterna, cioè dell'ambiente (la temperatura dell'aria coincideva con quella delle pareti). Applicando l'equazione 10 all'equazione 9 e risolvendo rispetto a θs:
| ` theta_s = ( b / (K sqrt(|a|)) [-i J_1 (i sqrt(|a|) R) ] + 1.21 E J_0 (i sqrt(|a|) R) theta_E ) /( K sqrt(|a|) [ -i J_1 (i sqrt(|a|) R ) ] + 1.21 E J_0 (i sqrt(|a|) R) ) ` | (11) |
Anche in questa equazione J1 rappresenta una funzione di Bessel di variabile immaginaria del primo ordine e del primo tipo.
In Fig. 17, la curva più in basso è stata tracciata considerando assente il flusso sanguigno e come unica fonte di calore la produzione locale del metabolismo dei tessuti (hm). Il valore di hm è stato valutato 0.0001 ` (cal)/(cm^3 s) ` grazie ai precedenti studi di Asmussen e altri [21, 22]; per il tracciamento della curva è stata utilizzata l'equazione 7b. Le altre curve tratteggiate sono state disegnate utilizzando le equazioni 9 e 11, esse mostrano una approssimazione molto prossima alla curva sperimentale. Tutte le curve sono state tracciate ipotizzando un equilibrio completo tra tessuti e sangue (k=0). Le migliori approssimazioni della curva si sono ottenute quando per la portata (V) sono stati assunti valori tra 0.00025 ` (cm^3) / s ` e 0.0005 ` (cm^3) / s ` [23, 24]. Nel caso di piccoli squilibri termici tra sangue e temperatura (k=0.25) il miglior valore della portata era tra 0.0003 ` (cm^3) / s ` e 0.0004 ` (cm^3) / s `; se viene a mancare l'equilibrio termico tra sangue e tessuti (k=0.5), i valori di V divengono 0.0004-0.0005 ` (cm^3) / s `. Le cause delle deviazioni tra la curva sperimentale e quella teorica possono essere numerose. Assumendo l'uniformità di hm, V e k certamente si aumenta il divario fra teorico e reale, ma è anche possibile che il ritorno venoso dalla porzione distale, alteri considerevolmente la distribuzione di temperatura all'interno dei tessuti.
Le curve teoriche di Fig. 17 sono quasi delle parabole perché la serie infinita di potenze definita dalla funzione di Bessel di ordine zero e di primo tipo, converge così rapidamente che nel campo dei valori di ` a=(V s (K-1))/K ` tutti i termini dopo r2 divengono trascurabili. Queste curve si allontanano dalla parabola verso la periferia del cilindro, cioè all'aumentare di r.
Conclusioni
Dall'analisi svolta da H.H.Pennes appare chiaro il ruolo del sangue negli arti, non solo come fonte di calore per i tessuti superficiali, ma anche per tutti i tessuti tra la pelle e l'asse del membro. Appare chiaro che se fosse stata possibile da misurare al, tempo di Pennes, la portata del sangue, la determinazione della distribuzione di temperatura e la temperatura dell'arteria brachiale avrebbe permesso di tentare il calcolo dell'andamento della produzione di calore nell'avambraccio. In questo modo si potrebbe verificare o criticare le ipotesi di uniforme distribuzione del calore e della portata.
Nella risoluzione dell'equazione della trasmissione del calore, è stata ipotizzata una simmetria cilindrica; ma la misura della temperatura cutanea ha mostrato una distribuzione tutt'altro che simmetrica. Con le nuove tecnologie e soprattutto la potenza di calcolo messa a disposizione dai moderni elaboratori uno sviluppo per un più approfondito studio sarebbe rielaborare le equazioni differenziali, trasformandole in equazione alle differenze finite, per verificare se con le condizioni al contorno trovate da Pennes risulti accettabile la simmetria cilindrica da lui ipotizzata.
Bibliografia
- [1] Bazett e McGlone, 1927, Am. J. Physiol., 82, 415
- [2] Pennes, 1948, J. Appl. Phys., 1, 93-122
- [3] Hardy e Soderstorm, 1937, Rev. Scient. Instr., 8, 419
- [4] Hardy, 1934, J. Clin. Investigat., 13, 605
- [5] Mendelson, 1936, Am. J. Physiol., 114, 175
- [6] Palmes e Park, 1947, Federation Proc., 6, 175
- [7] Du Bois, 1936, Basal Metabolism in Jealth disease, Philadephia, 79
- [8] Stewart e Haskell, 1946, Am. Heart J., 31, 343
- [9] Roth Horton et al., 1940, Am. J. Physiol., 128, 782
- [10] Foged, 1932, Skand. Arch. Physiol., 64, 251
- [11] Lewis e Love, 1926, Heart, 13, 27
- [12] Grant e Pearson, 1938, J. Clin. Sci., 3, 119
- [13] Lewis e Pickering et al., 1933, Heart, 16, 1
- [14] Foged, 1930, Skand. Arch. Physiol., 59, 109
- [15] Wright e Johnson, 1933, Proc. Soc. Exper. Biol. And Med., 30, 758
- [16] Hill, 1928, Proc. Roy. Soc. Lond., 103b, 138
- [17] Hardy e Soderstorm, 1938, J. Nutrition, 16, 493
- [18] Lomholt, 1930, Strahlentherap., 35, 324
- [19] Bordier, 1898, Arch. De Physiol. Normale et Path., 10, 17
- [20] Asmussen e Christensen et al., 1939, Skand. Arch. Physiol., 82, 212
- [21] Holling, 1939, Clin. Sci., 4, 103.
- [22] Abramson e Katzenstein et al., 1941, Am. Heart, 22, 329
- [23] Barcroft e Edholm, 1946, J. Physiol., 104, 366
- [24] Gagge e Wilnslow et al., 1938, Am. J. Physiol., 124, 30
- [25] Burton e Bazett, 1936, Am. J. Physiol., 117, 36
Interpretazione moderna dell'equazione di Pennes
Introduzione
In questo capitolo sono mostrati ed esaminati tutti gli sviluppi e gli utilizzi in campo biomedico degli studi compiuti da H. H. Pennes, con particolare riguardo all'equazione del calore presentata nel capitolo precedente.
La prima parte mostrerà l'attuale interpretazione fisico matematica dell'equazione. La seconda e la terza faranno vedere i cambiamenti principali a cui è stata sottoposta, sia da Kenneth attorno al 1970 che successivamente da Wissler nel 1998.
Interpretazione moderna dell'equazione di Pennes
Poiché l'equazione di Pennes è stata sviluppata attorno al 1948, negli anni a seguire è stata analizzata profondamente e reinterpretata anche a livello matematico. Benché oggigiorno la maggior parte degli studiosi sia scettica riguardo al metodo con cui Pennes elaborò la sua equazione, essa rimane uno strumento fondamentale usato per la progettazione di ogni apparato di indagine termica sull'uomo.
La formula esatta con cui oggi viene utilizzata è la seguente:
| ` rho_t c_t (d T)/(d t) = grad k_t grad T + rho_b c_b omega_b (T_a - T) + q_m ` | (12) |
che risulta sempre molto simile all'equazione di diffusione del calore:
` rho c (d T)/ (d t) = k grad^2 T + q_g `
nelle precedenti equazioni sia ρ, c , T e t hanno gli usuali significati4; mentre con ` omega_b ` si indica la portata del sangue per unità di volume dei tessuti, che ha dimensionalmente il valore di s-1 .
Per completezza sono riportati i valori riferiti all'uomo delle costanti nelle equazioni precedenti:
| Tipo | K ` ( W / (m * K)) ` | ` rho ` ` ( (k g ) / m^3 ) ` | c ` (J / (k g * K)) ` | ` omega_b ` ` ( 1/s) ` |
|---|---|---|---|---|
| Sangue | 0,49 | 1,05*10-31,06*10-3 | 3,59*1033,68*103 | |
| Cuore | 0,490,59 | 1,06*10-3 | 3,7*103 | 0,61 |
| Grasso | 0,20 0,22 | 0,85*10-3 0,94*10-3 | 2,2*103 2,4*103 | |
| Cervello | 0,16 0,57 | 1,04*10-3 1,05*10-3 | 3,6*103 3,7*103 | 0,32 |
| Fegato | 0,47 0,57 | 1,05*10-3 | 3,6*103 | |
| Pelle | 0,29 0,32 | 0,02 freddo 0,20 caldo | ||
| Ossa | 0,41 0,63 | 0,08 | ||
| Muscolo | 0,38 0,54 | 1,01*10-3 1,05*10-3 | 3,6*103 3,8*103 | 0,03 |
Tabella 1 Valori comuni nell'uomo dei parametri K, c, 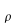 e
e 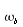 . I termini freddo e caldo sono messi vicino ai rispettivi valori per indicare le condizioni esterne.
. I termini freddo e caldo sono messi vicino ai rispettivi valori per indicare le condizioni esterne.
Lunghezza d'equilibrio
Nello studio dell'equazione di Pennes, un elemento ricorrente è la lunghezza d'equilibrio. Con questo termine è usualmente definita la distanza, tale che la differenza tra la temperatura del sangue e quella dei tessuti sia pari a 0,368. La Fig. 18 chiarisce ogni dubbio su tale valore.
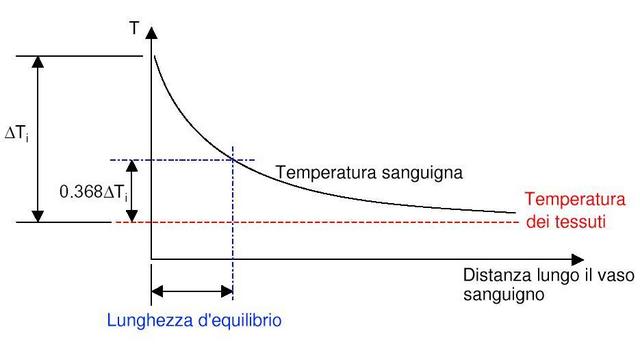
Fig. 18 Andamento della temperatura all'interno della sezione di un vaso sanguigno, al variare del raggio.
La lunghezza d'equilibrio può essere calcolata con la seguente formula:
` l_e = (rho * c)_b * r_b ^2 * u_b * [ 1 / (N u * k_b) + ln(r_t / r_b) / (2 * k_b ) ] `
Dove Nu è il numero di Nusselt del sangue, rt il raggio del cilindro di tessuto attorno al vaso, e rb il raggio del vaso sanguigno; il rapporto ` r_t / r_b ` generalmente varia tra 10 e 25.
Una volta nota la lunghezza d'equilibrio è possibile stabilire l'andamento della temperatura all'interno del vaso sanguigno, attraverso tutta la lunghezza del braccio (x):
` (T(x) - T_t ) / (T_i - T_t ) = e ^(- X/ l_e)`
Meccanismo di trasferimento del calore negli arti
Nel primo capitolo è stato esaminato il metodo compiuto da Pennes per stabilire la distribuzione delle temperature all'interno dell'avambraccio. I suoi risultati sono validi per tutti e quattro gli arti, ma il processo che conduce a tali distribuzioni è stato, ed è tuttora, sede d'indagine.
La teoria più accredita afferma che in condizioni "normali", cioè in situazioni in cui l'organismo non debba produrre calore con la contrazioni involontarie dei muscoli, oppure non debba cedere calore con la produzione di sudore, il flusso termico all'interno dell'arto sia nella direzione arterie-vene. Sostanzialmente le arterie assurgerebbero a fonte di calore per l'arto, mentre le vene ritornando al cuore e ai polmoni, e trovandosi a temperatura più bassa, assorbirebbero una parte del calore trasportato dalle arterie.
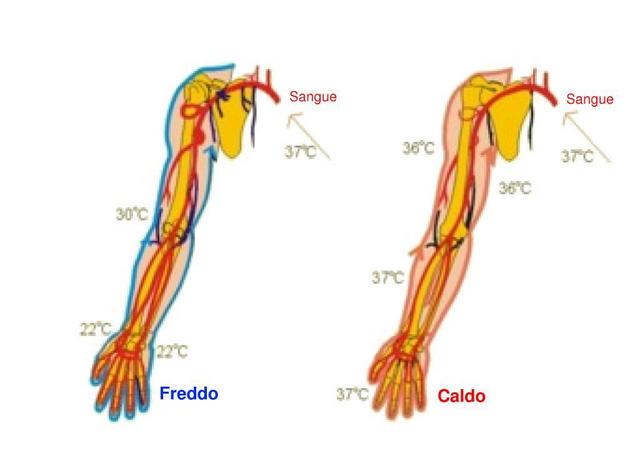
Fig. 19 Distribuzione tipica di temperature dell'avambraccio destro in condizioni di caldo e freddo all'esterno.
Se prendiamo a esempio ancora l'avambraccio destro, vedi Fig. 19, possiamo avere diverse distribuzioni di temperatura all'esterno del braccio, ma il sangue che affluisce al braccio rimane sempre attorno ai 37°C. La differenza di temperatura tra le arterie e le vene rimane costante nel tempo e diminuisce con l'avvicinarsi alla periferia dell'arto. Il sistema di vene arterie sotto questa ottica costituisce uno scambiatore di calore in controcorrente in cui l'ascissa che determina la differenza di temperature risulta la distanza dal centro del corpo (v. Fig. 20).
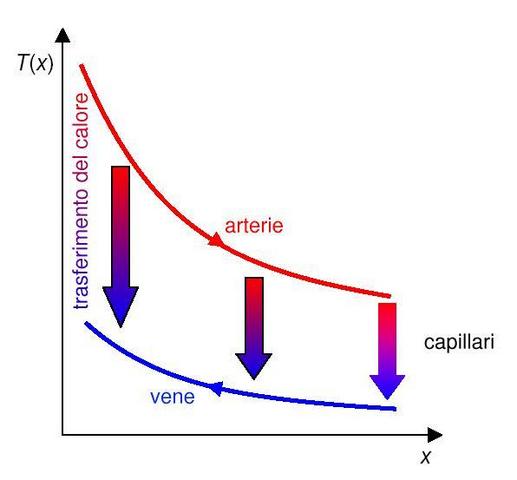
Fig. 20 Andamento delle temperature delle arterie e delle vene. L'ascissa rappresenta la distanza dal centro del corpo. La lunghezza delle frecce è proporzionale al calore scambiato tra arterie e vene.
Comunque vi sono delle differenze molto importanti rispetto ad uno scambiatore in controcorrente:
- innanzi tutto in entrambi i sensi viene trasportato lo stesso fluido
- i due flussi non sono propriamente separati, ma hanno un continuo scambio di fluido, costante nel tempo
- lo scambio di calore tra i due tipi di vasi passa attraverso i tessuti
Gli studi di Keller
Intorno agli anni settanta, gli studi sulle capacità del corpo umano di mantenere la propria temperatura costante in un certo intervallo, mostrarono che all'interno del nostro organismo alcuni tessuti possono variare la loro resistenza al passaggio del calore. Il modo in cui avviene questo cambiamento dipende dal metodo con cui avviene il trasferimento di calore; il trasferimento più ovvio è per conduzione attraverso gli strati proteici e grassi dei tessuti sottocutanei. La composizione e la conduttività termica di questi due tipi è fortemente diversa, gli strati proteici trasmettono da dieci a tredici volte di più del grasso; inoltre la mancanza di strati isotermi nelle vicinanze influisce sul trasferimento di calore attraverso di essi [10, 13].
Sovrapposta a questo trasferimento per conduzione, vi è il trasferimento per convezione regolato dall'azione vasomotrice. Secondo molti ricercatori la fuga di calore all'interno di un arto è proporzionale al grado di perfusione locale sanguigna [5, 9,11]. La vasodilatazione aumenta il grado di perfusione e quindi lo smaltimento del calore, mentre la vasocostrizione ottiene, ovviamente, l'effetto opposto. Comunque la quantificazione di questo fenomeno è difficile, poiché le relazioni sono con coefficienti non lineari e la soluzione non è unica.
In aggiunta a ciò bisogna considerare lo scambio di calore fra le grandi arterie e vene che scorrono controcorrente le une alle altre. Attraverso gli studi di Bazett [1, 2], che ha esaminato grandi regioni degli arti sia superiori che inferiori, sappiamo che i grandi vasi arteriosi sono effettivamente raffreddati prima di entrare nei letti capillari; ciò riduce di molto sia il calore che può portare un arteria e sia il calore che può smaltire una grande vena. Scholander e Krog [17] hanno identificato e definito una struttura vascolare chiamata "reti" che ha lo scopo primario, in certe specie, di conservare il calore. Questo struttura è formata da arterie e vene che sono molto vicine e quasi impacchettate le une alle altre in una matrice di scambiatori in controcorrente. L'effetto maggiore di questa disposizione è di diminuire moltissimo il trasferimento di calore tra sangue e le estremità con grandi superfici di scambio.
Sarebbe logico aspettarsi una distribuzione del genere anche in prossimità dei capillari, dove piccole arterie e vene passano molto vicine controcorrente, ma, a causa della distribuzione di questi canali assolutamente casuale, il bilancio del calore segue generalmente quello dei tessuti.
Lo studio di Keller cerca di sviluppare un modello per i tessuti sottocutanei contemplando contemporaneamente sia gli effetti della conduzione, della convezione sia quella della produzione di calore e dello scambio di calore controcorrente. La novità maggiore rispetto ai ricercatori precedenti Keller riguarda proprio la contemporaneità; secondo quest'ultimo non è lecito analizzare i singoli effetti e poi sommarli poiché i coefficienti che governano le equazioni sono di natura non lineare [4, 9].
Modelli e equazioni
Idealmente Keller divide ciò che al di sotto della pelle in due regioni (v. Fig. 21), un centro isotermo e una periferia dove la temperatura varia da quella del centro a quella della pelle.
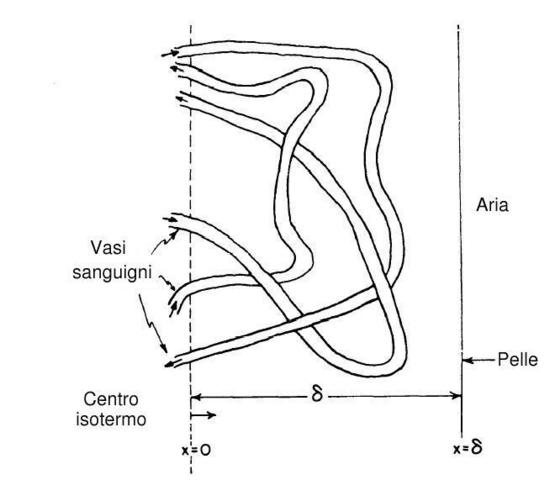
Fig. 21 Schematica rappresentazione del tessuto subcutaneo, enfatizzando la vascolarizzazione e la variazione di temperatura.
L'effettivo spessore della regione periferica dipende principalmente dal tasso di perfusione sanguigna e dalla conduttività dei tessuti, secondariamente dal tasso di produzione di calore e dal grado di preraffreddamento arterioso. Le regioni periferiche del tessuto variano in maniera più o meno continua, partendo dal tessuto connettivo, ben vascolarizzato, al tessuto adiposo scarsamente vascolarizzato.
Se lo spessore della regione periferica è piccolo rispetto al locale raggio di curvatura della superficie, e si restringe l'attenzione alle regioni locali in prossimità, dove la temperatura varia solo lungo la direzione normale alla superficie, il sistema può essere considerato unidimensionale. Il flusso di calore trasferito in queste zone usualmente viene espresso in termini di conduttività effettiva (keff):
| ` H = k_(e f f) / delta (T_b - T_s) ` | (13) |
Dove H rappresenta il flusso di calore, ` delta ` rappresenta lo spessore della regione periferica, Tb e Ts sono rispettivamente la temperatura del centro isotermo, "body temperature", e della superficie esterna della pelle. Se la produzione del calore nel tessuto periferico non è trascurabile, allora l'applicazione della 13 deve essere fatta con attenzione, cioè deve essere aggiunta la quota parte prodotta dai tessuti al flusso termico che avviene tra esterno ed interno.
Il problema dello studio di Keller è proprio nel determinare il valore di keff tenendo conto delle interazioni dei vari meccanismi di trasferimento del calore nei tessuti. Per questo studio Keller si è rifatto ad un'interpretazione dei tessuti, formati da una complessa microstruttura, come un continuo, seguendo la strada aperta da Pennes.
Per lo studio che segue vengono utilizzate le seguenti notazioni:
- a: area dello scambio di calore per unità di volume ` ( 1 / (c m) )`
- c: calore specifico ` ((c a l) / (g * °C) )`
- ` dot g ` : perfusione capillare ` (g / (cm^3 * s)) `
- h: coefficiente del flusso di calore dai vasi ai tessuti circostanti ` ((c a l) / (cm^2 * s * °C)) `
- H : flusso termico di calore termico nello strato non isotermo ` ((c a l) / (cm^2 * s)) `
- ` dot J ` : potenza del calore prodotto dal metabolismo ` ((c a l) / (cm^3 * s)) `
- k : conduttività del tessuto ` ((c a l) / (cm * s * °C))`
- keff : conduttività effettiva del tessuto ` ((c a l) / (cm * s * °C))`
- l : lunghezza dei vasi per unità di lunghezza del tessuto, chiamata anche tortuosità dei vasi, (adimensionale)
- ` dot m ` : portata sanguigna in massa per unità di sezione ` (g / (cm^2 * s)) `
- n : numero di vasi per unità di volume
- T: temperatura (°C)
- x: lunghezza in direzione normale alla superficie (cm)
- ` delta ` : spessore del tessuto (cm)
La Fig. 22 è una schematizzazione molto semplice di tutti i fenomeni di scambio di calore all'interno di una piccola regione in uno strato di tessuto. La singola arteria e vena rappresentano l'effettiva terminazione di una rete di arterie e vene in direzione normale alla superficie. I capillari disegnati mostrano le maglie di microvascolarizzazione che unisce arterie e vene attraverso tutta la rete di distribuzione. La portata di sangue che scorre nella arteria idealizzata decresce lentamente dal centro alla periferia, poiché il sangue lascia l'arteria andando ad alimentare la perfusione dei capillari. Anche la sua temperatura va diminuendo perché una parte di calore si trasferisce, attraverso le pareti, ai tessuti. Similmente, ma in verso contrario, avviene lo stesso passaggio di calore dai tessuti alla vena, e anche per il sangue che gradualmente dai capillari entra nella vena.
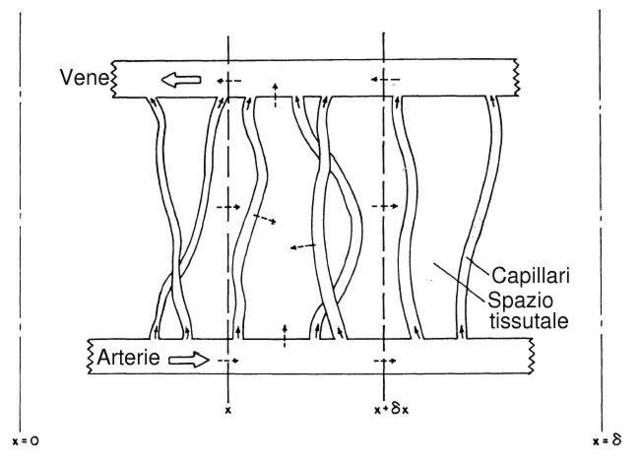
Fig. 22 Diagramma schematico di un elemento della regione subcutanea, illustrante i più importanti metodi di trasferimento del calore. Le frecce tratteggiate indicano le vie di trasferimento del calore, le frecce continue indicano la direzione del sangue.
Compiendo dei bilanci di energia tra il sangue arterioso, il sangue venoso e i tessuti, si possono determinare le variazioni delle principali temperature rispettivamente: Tar, Tve e T.
Si consideri un processo quasi stazionario, il bilancio energetico su un volume di tessuto di grandezza infinitesima compreso tra l'intersezione del piano x e l'intersezione del piano ` x + delta x `, come mostrato nella Fig. 22; sei termini sono coinvolti nel bilancio:
- La conduzione del calore attraverso il piano x proporzionale a ` -k((dT)/(dx))_x `, indicando con k la conduttività del tessuto.
- La conduzione del calore attraverso il piano ` x + delta x ` proporzionale a ` -k((dT)/(dx))_(x + delta x) `.
- Il calore passa dai capillari allo spazio tissutale. La perfusione del sangue nei capillari a livello locale è proporzionale a ` dot g ` cioè alla portata in massa per unità di volume. Questo sangue entra nei capillari alla temperatura locale dell'arteria, Tar, ma a causa dell'elevato rapporto superficie volume e per la relativamente lunga permanenza del sangue nei capillari, esso raggiunge la temperatura di equilibrio T prima di essere raccolto dal sistema venoso. Quindi il calore trasferito allo spazio tissutale risulta pari a ` c_(b l) {:dot g :} ( T_(a r) - T) delta x ` espresso in (cal/s).
- Il calore proveniente dalle arterie verso lo spazio tissutale. Se si identifica tutta la superficie del mantello delle arterie per unità di volume con il valore aar, e il valore del coefficiente di scambio termico, sempre dalle arterie allo spazio tissutale, har, allora il calore scambiato sarà: ` h_(a r) a_(a r ) (T_(a r) - T) delta x ` .
- Il calore fornito dallo spazio tissutale alle vene. Per analogia con la precedente: ` h_(v e ) a_(v e ) (T_(v e) - T) delta x ` .
- Il calore generato dal metabolismo dei tessuti: ` dot J delta x `
Combinando insieme questi sei termini il bilancio energetico diventa:
| ` k((dT)/(dx))_(x + delta x) - k((dT)/(dx))_x + c_(b l) {: dot g :} ( T_(a r) - T) delta x + h_(a r) a_(a r ) (T_(a r) - T) delta x + h_(v e ) a_(v e ) (T_(v e) - T) delta x + dot J delta x = 0 ` | (14) |
Dividendo per ` delta ` e, per ` delta -> 0 `, si ottiene:
| ` k (d^2 T)/(d x^2) + (h_(a r) a_(a r) + c_(b l) dot g )*(T_(a r) - T) + h_(v e) a_(v e) (T_(v e) - T ) + dot J = 0 ` | (15) |
Il bilancio energetico delle arterie che passano attraverso il volume infinitesimo è in qualche modo differente, poiché è ragionevole considerare il calore per conduzione lungo x trascurabile rispetto al calore trasferito per convezione. Questo calore trasferito tra i piani x e ` x + delta x ` è funzione della portata arteriosa rispetto alla sezione dell'arteria ` dot m_(a r) ` ( espressa in ` g / (cm^2 s)` e della temperatura dell'arteria. La perdita di energia è data dal sangue che scorre nei capillari e dal passaggio del calore verso i tessuti. Il bilancio, sempre in condizioni quasi stazionarie, è:
| ` (c_(b l) dot m_(a r) * T_(a r))_x - (c_(b l) dot m_(a r) T_(a r))_(x + delta x) - c_(b l) {:dot g :} T_(a r) delta x - h_(a r) a_(a r) (T_(a r) - T) delta x ` | (16) |
Che divisa per ` delta x ` e facendo il limite per ` delta x -> 0 ` porta:
| ` d/(d x) (c_(b l) {: dot m_(a r) :} T_(a r) ) + c_(b l) {:dot g :} T_(a r) + h_(a r) a_(a r) (T_(ar) - T) = 0 ` | (17) |
Similmente il bilancio energetico del sangue venoso è:
| ` -d/(d x) (c_(b l) {: dot m_(v e) :} T_(v e) ) + c_(b l) {:dot g :} T + h_(v e) a_(v e) (T - T_(v e)) = 0 ` | (18) |
Le equazioni 15, 17 e 18 possono essere ulteriormente semplificate. La conservazione della massa mostra che `dot m_(a r)` è dato da:
| `dot m_(a r) = (dot m_(a r))_0 - int_0 ^x {:dot g:} dx ` | (19) |
Con `(dot m_(a r))_0 ` si indica la portata che parte dal centro e va verso la periferia. Inoltre per la vena abbiamo:
| `dot m_(v e) = (dot m_(v e))_0 + int_0 ^x {:dot g:} dx ` | (20) |
E
| ` (dot m_(v e))_0 = - (dot m_(ar ) )_0 ` | (21) |
Chiaramente il segno meno indica che i versi positivi sono presi concordi all'asse delle x, nel verso dell'incremento della x. Inoltre bisogna notare che:
| `(d dot m_(a r) )/ (dx) = - {: dot g :} = - (d dot m_(v e))/ (dx )` | (22) |
E' ragionevole considerare che il numero di vene e di arterie nel volume preso in esame sia circa lo stesso, al massimo che differiscano per una costante moltiplicativa molto prossima a uno. Sebbene sia possibile introdurre tale costante nei prossimi calcoli essa non introdurrebbe nulla di nuovo all'interno delle equazioni, solo una piccola differenza numerica nel risultato finale; perciò sarà assunta al valore uno e conseguentemente:
| `h_(a r) a_(a r) ~~ h_(v e) a_(v e) -= h a ` | (23) |
Quindi il coefficiente di trasferimento del calore sarà lo stesso sia per le arterie che le vene e i tessuti.
Sostituendo le equazioni 20, 22 e 23 nelle equazioni 15, 17 e 19 si ottengono le seguenti equazioni di bilancio:
| `k (d^2 T)/(dx^2) + (h a + c dot g) (T_(a r) -T) + h a (T_(v e) - T) + {:dot J:} = 0 ` | (24) |
| ` [(dot m_(a r))_0 - int_0 ^x {:dot g:} dx] c (d T_(a r))/ (dx) + h a ( T_(a r) - T) = 0` | (25) |
| ` [(dot m_(a r))_0 - int_0 ^x {:dot g:} dx] c (d T_(v e))/ (dx) + (h a + c {:dot g:})( T - T_(v e)) = 0` | (26) |
Il pedice bl è stato sottinteso perché c si riferisce univocamente al sangue. Poiché non c'è alcun flusso di sangue che attraversa il piano ` x = delta `, le condizioni al contorno appropriate sono:
| ` {(x = 0 => T=T_(a r)= T_b),(x = delta => T = T_(v e) = T_S ):} ` | (27) |
Il flusso termico di calore è dato da:
| `H=-k((d T)/ (dx))_(x = delta) ` | (28) |
Combinata con la 13 porta a:
| ` k_(e f f) = - delta / (T_b - T_S) k ((d T)/ (dx))_(x = delta) ` | (29) |
In questa maniera la soluzione delle equazioni 24, 25 e 26 ci porta a calcolare l'effettivo valore di keff.
Casi limite
Per calcolare facilmente la soluzione delle equazioni 24-26 si può inizialmente vedere il caso in cui non ci sia interazione vascolare, cioè ci sia scambio di calore tra sangue arterioso e sangue venoso. La forma è la seguente:
| ` (T_(a r) - T)/(T_b - T_S) = 1 , x< delta ` | (30) |
| ` (T - T_b) / (T_S - T_b) = 1 / (e^(lambda delta) - e^(- lambda delta)) {[1 - Phi (e^(- lambda delta) - 1)]e^(lambda delta) - [1 - Phi (e^(lambda delta) -1)]e^(- lambda delta)} - Phi ` | (31) |
Dove con
| ` lambda -= sqrt ((c dot g) / k) ` | (32) |
| ` Phi -= (dot J) / ((T_b - T_S) c dot g )` | (33) |
Sostituendo l'equazione 31 nella 29 otteniamo l'espressione di keff per questo caso particolare:
| ` ( (k_(e f f))_(h a = 0) ) / k = (lambda delta) / (tanh ( lambda delta) ) + ( {:dot J:} delta ^2) / (T_b - T_S) (tanh ( ( lambda delta) / 2 )) / (k lambda delta) ` | (34) |
L'equazione 345 fornisce una base per determinare gli effetti della produzione di calore da parte del metabolismo su keff.
La Fig. 23 mostra come vari il rapporto `( (k_(e f f))_(h a = 0) ) / k ` al variare del prodotto `lambda delta` per diversi valori del gruppo parametrico ` ( {:dot J:} delta ^2) / (T_b - T_S) ` . La conduttività termica, k, viene considerata pari a ` 9 * 10^-4 (c a l) / (cm * s * °C)` .
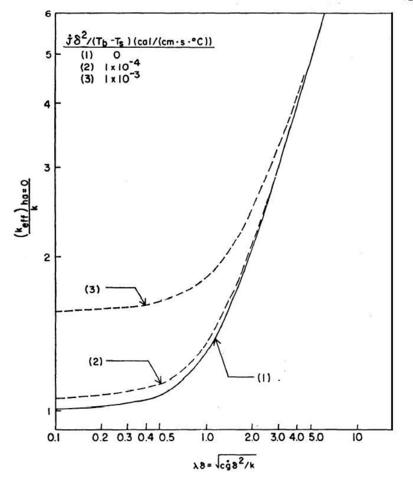
Fig. 23 L'illustrazione mostra la dipendenza della conduttività termica effettiva dalla quantità adimensionale `lambda delta`, nel caso limite di scambio di calore trascurabile tra arterie e vene. Le curve si riferiscono a differenti produzioni di calore da parte del metabolismo.
Come sarà mostrato nell'appendice 2 a fine capitolo, il valore massimo del gruppo parametrico è circa ` 1,8 * 10^-3 (c a l) / (cm * s * °C) ` Comunque, questo valore è probabilmente più alto di quello che può effettivamente essere riscontrato all'interno del corpo umano. Per esempio Pennes suggerisce (v. pag.45) un tasso metabolico pari a 0.0001 cal/(cm3·s). Se si considera che in queste circostanze (Tb-Ts) sia attorno ai 4°C e ` delta ` 2 cm, allora ` ( {:dot J:} delta ^2) / (T_b - T_S) ` è uguale a ` 10^-4 (c a l) / (cm * s * °C)`, corrispondente alla linea indicata con 2 nella Fig. 23. Se il muscolo è in esercizio, invece, il tasso metabolico sale di un fattore 100 fino ad arrivare a 0.01 cal/(cm3·s), ` delta ` tende a diminuire e (Tb-Ts) tende ad aumentare; considerando ` delta ` pari a 1 cm e (Tb-Ts) pari a 10°C, ` ( {:dot J:} delta ^2) / (T_b - T_S) ` diviene ` 10^-3 (c a l) / (cm * s * °C)`, tutto ciò è rappresentato dalla linea indicata con 3 in Fig. 23. La linea indicata con 1 rappresenta l'andamento di `( (k_(e f f))_(h a = 0) ) / k ` in assenza di attività da parte del metabolismo.
Da questa analisi si nota come l'effetto del metabolismo su keff vari con il prodotto ` lambda delta `, infatti quando ` lambda delta -> 0` l'effetto risulta massimo, può arrivare fino a valori 1,56 maggiori dei casi di assenza di metabolismo. All'aumentare di ` lambda delta `, invece, questo effetto diminuisce considerevolmente; per la curva superiore, la deviazione è del 40% per ` lambda delta = 1 `, mentre per ` lambda delta = 3 ` è solo del 10%. In tutto il muscolo restante la deviazione è appena del 5% per valori di ` lambda delta` maggiori di 1.
Quindi per un muscolo a riposo o per situazioni in cui la perfusione sanguigna sia sufficientemente alta, lo sviluppo di calore da parte del metabolismo può essere trascurata, perciò si possono utilizzare le seguenti semplificazioni per le equazioni 31 e 34:
| ` (T - T_b) / (T_a - T_b) = (e^(lambda x) - e^(- lambda x))/ (e^(lambda delta) - e^(- lambda delta) ) ` | (35) |
| ` ( (k_(e f f))_(h a = 0) ) / k = ( lambda delta) / (tanh( lambda delta))` | (36) |
L'equazione 36 rappresenta la curva continua indicata con 1 nella Fig. 23.
In Fig. 24 vediamo il grafico della forma adimensionale della temperature dei tessuti, espressa dall'equazione 36, in funzione di x al variare di ` lambda `e `delta`.
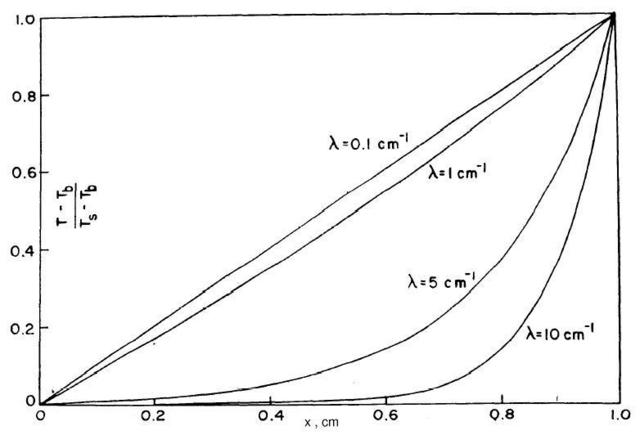
Fig. 24 Curve della temperatura per `delta = 1 cm` e per ha=0, al variare di `lambda`.
Notiamo che quando `lambda` è molto minore di ` 1 / delta ` la curva è essenzialmente lineare, come se il processo fosse per conduzione pura, e quindi keff=k, la conduttività dei tessuti. Chiaramente in queste circostanze la perfusione dei capillari non ha nessun ruolo.
Aumentando `lambda` la deviazione dalla linearità comincia a denotarsi in maniera sempre più evidente, e per ` lambda ` è molto maggiore di ` 1 / delta` la variazione tra la temperatura esterna e quella del centro non varia più linearmente, ma varia in maniera brusca a partire da una distanza pari a ` 1 / lambda` dall'interfaccia. Per valori così grandi di `lambda` l'equazione 36 indica che ` k_(e f f ) = k lambda delta = sqrt( c {:dot g:} k delta )` e perciò il flusso termico è proporzionale a `k_(e f f) / delta` e H è indipendente dalla scelta di `delta`.
In questo paragrafo abbiamo visto come il prodotto `lambda delta`, rappresentativo del grado di perfusione sanguigna dei capillari, e dello spessore dello strato non isotermo, in particolare gli effetti per valori del prodotto maggiori di 1(v. Fig. 23).
Soluzione generale dell'equazione
La soluzione delle equazioni 24-26 è complicata, poiché possiede coefficienti variabili. In ogni caso se il metabolismo può essere trascurato e `dot g` si può ritenere costante, le equazioni possono essere risolte (v. Appendice 1 alla fine del capitolo). La soluzione può essere espressa nella seguente forma:
| `(T-T_S) / (T_b - T_S) = f(zeta, mu) / f(zeta_0,mu) ` | (37) |
Dove
| ` f(zeta,mu)= int_0 ^zeta [ sqrt(z') I_nu (z') int_0 ^(z') z^(- 3/2) I_(-nu)(z) dz - sqrt(z') I_(-nu)( z') int_0 ^(z') z^(-3/2) I_nu(z) dz +A sqrt(z') I_nu( z') ]dz ` | (38) |
E
| `nu -= mu + 1/2 ` | (39) |
| `zeta -= (lambda delta)(1+ 2 mu)^(1/2) (1 - x / delta) ` | (40) |
| `mu -= (h a) / (c dot g) ` | (41) |
La soluzione vista porta come caso limite proprio ha=0, descritto dall'equazione 35. Ricordando l'equazione 29 abbiamo:
| ` k_(e f f ) = (- 2 k sin(nu pi)) / (pi f(zeta_0,mu)) ((lambda delta) sqrt(2 mu + 1)) / (mu(mu + 1)) ` | (42) |
La funzione ` f(zeta,mu)` può essere determinata utilizzando la funzione di Bessel, rappresentata da una serie infinita (v. Nota a Pag.44), troncandola generalmente al quinto termine. Nella Fig. 25 sono mostrati i risultati tipici del rapporto delle temperature facendo variare ha e considerando costante la perfusione dei capillari. Si vede come l'aumento di ha contrasti l'effetto della perfusione fino a raggiungere, come caso estremo, per `h a -> oo `, una curva lineare con `k_(e f f ) -> k`.
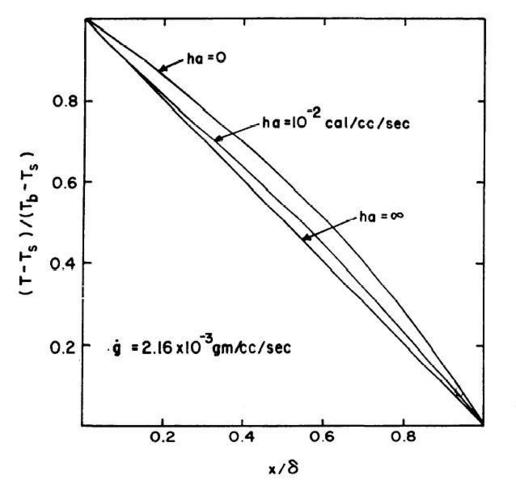
Fig. 25 Curve del rapporto adimensionale riguardante la temperatura, considerando costante la perfusione dei capillari.
E' evidente dall'equazione 42 che l'effetto di ha su keff si ha attraverso `mu` che è il rapporto tra ha e `c dot g`. Nella Fig. 26 è indicata la curva di keff al variare di `mu`. Il grafico indica l'interazione delle arterie e delle vene nei tessuti, modificando il valore di keff. Utilizzando quest'ultimo grafico con quello precedente (Fig. 25) si può determinare agevolmente il valore reale di keff per una qualsiasi situazione.
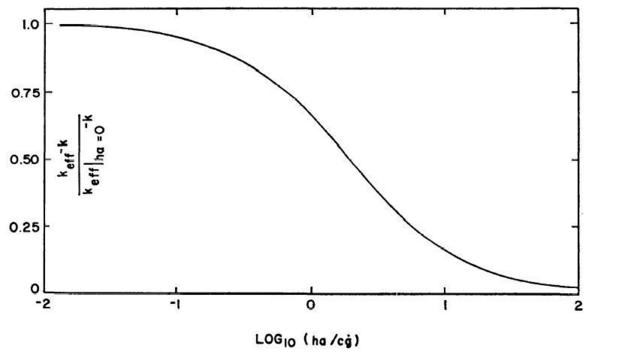
Fig. 26 Dipendenza della conducibilità effettiva dal rapporto tra lo scambio di calore arterie-vene e lo scambio dovuto alla perfusione dei capillari.
Conclusioni
Gli sviluppi analitici presentati in questo capitolo mostrano come la conduttività effettiva dei tessuti dipenda da un ristretto numero di parametri. Questi parametri sono:
`k_(e f f) = F(lambda delta, mu, Phi)`
Bisogna ricordare che benché i gruppi parametrici siano stati scelti dopo alcune assunzioni, questi particolari gruppi mantengono il loro significato anche senza scegliere determinate ipotesi esemplificative. Per riassumere il loro significato:
- `(lambda delta)` è una misura dell'importanza della perfusione dei capillari nella conduzione attraverso i tessuti.
- `mu` misura l'importanza del preraffreddamento arterioso nello scambio di calore dei capillari.
- `Phi` è il rapporto tra tutto il calore generato dalle regioni sottocutanee e il massimo calore che è possibile trasferire attraverso le perfusione dei capillari. Il suo valore determina la necessità di considerare il calore sviluppato dalle regioni periferiche, attraverso il metabolismo, nel modello di calcolo della conducibilità effettiva.
Da questo studio, inoltre, emergono altre importanti informazioni. Prima fra tutte la scarsa importanza nella conduzione del variare delle sezioni dei vasi sanguigni, per azione dell'organismo. Il minimo valore di keff risulta la conduttività dei tessuti presi singolarmente. Per il primo strato proteico è pari a `0,9*10^-3 (c a l) / (cm * s * °C)` mentre per lo strato adiposo `0,45*10^-3 (c a l)/(cm*s*°C)`. L'errore che si compie prendendo questi valori, finché si ha `lambda delta <= 0,32`, è inferiore al 3%. Proprio per questo motivo la vasocostrizione è di scarsa utilità per prevenire perdita di calore all'organismo, con valori della perfusione attorno a questi livelli. D'altro canto, anche l'effetto della vasodilatazione è inefficace, poiché keff risulta la media geometrica tra k e `c (dot m_(a r))_0 delta` e perciò risulta limitata da k. Il risultato di tutto ciò è che, benché keff possa variare di due ordini di grandezza, la variazione risulta limitata, sotto questo profilo, di solo quattro unità.
Sovrapposto alla perfusione sanguigna e alla conduzione nei tessuti vi è il preraffreddamento delle arterie dovuto all'interazione arterie-vene. Come precedentemente scritto, questo fenomeno diventa importante quando `h a >= 0,1(c dot g)`. Sebbene l'effetto del preraffreddamento tenda a diminuire la variabilità della conducibilità effettiva, ha anche il risultato di rendere più sensibile keff alle variazioni di `dot g`. Per questo motivo un aumento di `dot g` provoca un aumento di keff in due maniere: aumentando la perfusione capillare e diminuendo il preraffreddamento arterioso.
E' possibile fare una semplice stima di questo valore da considerazioni di tipo anatomico. La superficie dell'interfaccia per lo scambio termico, per unità di volume può essere approssimata dal cilindro di un vaso sanguigno:
`a = n/2 (2 pi r_0 l)`
avendo indicato con n il numero totale di grandi vasi e considerandone la metà arterie e l'altra metà vene. Con l si indica la tortuosità, cioè la lunghezza di un vaso nell'unità di lunghezza. Se si adotta come modello un cilindro, allora h può essere preso come il valore della conduzione radiale attraverso la regione anulare da r=r0, diametro del vaso sanguigno, a r=R, metà della distanza fra i vasi:
`h ~~ k / (r_0 ln(R/r_o))`
Generalmente n è uguale a `1 / (4R^2)`, quindi:
`h a ~~ (pi k l) / (4R^2 ln(R/r_o))`
Questo semplice modello ha il vantaggio di permettere una stima da un'osservazione visiva dei campi di variazione dei parametri. Per esempio se R misurasse 0,5 cm, r0 circa 0,05 cm, e i vasi fossero abbastanza rettilinei, allora nello strato proteico `h a ~~ 1,2*10^-3 (c a l) / (cm^3 * s * °C)` e, in accordo con la Fig. 26, il grado di perfusione dei capillari sarebbe `1*10^-3 g / (cm^3*s)`, quindi il valore di keff sarebbe ridotto di 0,56 del valore che avremmo riscontrato in assenza di interazione vascolare.
Questo studio, che fornisce le basi per la stima della conduzione effettiva considerando tutti i meccanismi di scambio all'interno dei tessuti, può essere migliorato. Un primo raffinamento si può ottenere rendendolo indipendente dalla distanza dalla pelle. Inoltre sarebbe molto più realistico considerare sia `dot g` che k variabili con continuità dal centro alla periferia, in questo modo si renderebbero più appropriate le variazioni delle caratteristiche dei tessuti. D'altra parte questi miglioramenti aumenterebbero la complessità delle equazioni in maniera significante, perciò per intraprendere questa strada bisogna essere certi che il risultato dia dei valori che siano sia qualitativamente che quantitativamente differenti.
Appendice 1: risoluzione delle equazioni 24-26
Per risolvere le equazioni 24, 25 e 26 conviene innanzitutto porle in una forma adimensionale, e per fare ciò consideriamo costante ` dot g `:
| ` (1+ 2 mu ) {d^2 theta} / {d zeta^2} = (1+2 mu) theta - ( 1+mu) theta_(a r) - theta_(v e) + Phi ` | (43) |
| ` zeta {d theta_(ar)} / {d zeta} = mu ( theta_(ar) - theta) ` | (44) |
| ` zeta {d theta_(v e)}/ {d zeta} = (mu + 1) ( theta - theta_(v e)) ` | (45) |
Con le condizioni al contorno:
| ` theta = theta_(a r) = 1 `, quando ` zeta = lambda delta sqrt(1 + 2 mu) = zeta_0 ` | (46) |
| ` theta = theta_(v e) = 0 `, quando ` zeta = 0 ` | (47) |
Dove
| ` theta = {T - T_s} / {T_b - T_s} ` | (48) |
Se ` Phi ` è trascurabile, le equazioni 43-45 possono essere trasformate in una singola equazione di quarto grado:
| ` theta^(I V) + 2 / zeta theta^(I I I) - [ 1+ {mu (mu+1)}/ zeta^2 ] theta^(I I) - 2 / zeta theta^I = 0 ` | (49) |
La soluzione di questa equazione richiede due condizioni al contorno aggiuntive riguardanti ` theta `. La prima è immediata:
| ` theta^I (0) != oo ` | (50) |
La seconda è data dal bilancio energetico globale:
| ` H= (dot m_(a r) )_0 c (T_(a r ) - T_(v e) )_0 -k({d T}/ {d x})_(x=0) = -k ({d T}/ {d x })_(x= delta) ` | (51) |
Che combinato con l'equazione 43, 46 e 47 porta a:
| ` theta^(I I) (zeta_0) = mu / zeta_0 [ theta^I (0) - theta^I (zeta_0) ] ` | (52) |
A questo punto l'equazione 45 è ridotta a una equazione di terzo grado in ` theta^I `.
Appendice 2: massimo valore del gruppo parametrico
Per determinare il massimo valore di ` {dot J delta^2} / {T_b - T_s} ` si deve innanzitutto ricordare che vogliamo analizzare solo la regione sottocutanea in cui il calore passa da nucleo centrale verso la pelle, cioè dove la temperatura e più bassa rispetto alla temperatura interna locale, Tb. Questa è la regione dove la produzione locale di calore dovuta al metabolismo è uguale o minore del calore rimosso localmente dalla superficie esterna della pelle. Se la produzione di calore da parte del metabolismo eccedesse questo valore, l'equazione 31 avrebbe un massimo, in altri termini esisterebbe un valore di T maggiore di Tb nella regione sottocutanea. Se indichiamo con x=xm la posizione in cui si trova questo massimo, allora il calore sarebbe trasferito all'esterno, verso la pelle, per x > xm e all'interno verso il nucleo per x<xm. Sotto queste condizione verrebbe considerata la zona d'interesse solamente la regione compresa tra x=xm e ` x= delta ` , determinando il valore di keff solo per questa zona. Se poniamo ` delta_m = delta - x_m ` , come è stato determinato con h attraverso l'equazione 31, anche per ` delta_m ` il valore più grande si ha per ` lambda -> 0 `, cioè per valori della perfusione sanguigna trascurabili.
Quindi per determinare il massimo valore del gruppo parametrico ` {dot J delta^2} / {T_b - T_s} `, si deve prima calcolare il massimo valore di ` delta_m ` corrispondente ad un dato valore di ` dot J `; e considerando che:
| ` {k_(e f f)} / delta_m (T_m - T_s) >= dot J delta_m ` | (53) |
In questa maniera abbiamo trovato Tm che è la massima temperatura sottocutanea. Successivamente sostituendo keff utilizzando l'equazione 34, per ` lambda delta -> 0 `, otteniamo:
| ` {dot J delta_m^2} / {T_m - T_s } <= 2k ` | (54) |
Il che significa che il massimo valore risulta pari a ` 1,8 * 10^-3 {c a l} / {cm * s * °C} `
L'ultima rivisitazione degli studi di Pennes
Nella letteratura scientifica lo studio della trasmissione del calore è sempre stata accompagnata dall'ausilio dell'equazione di Pennes, e per questo motivo è sempre stata soggetta a indagini e critiche molto severe. L'ultimo di questi studi risale al 1998, per opera dell'ingegnere Eugene H. Wissler, docente all'università di Austin in Texas.
La critica maggiore a cui sono sottoposti gli studi di Pennes riguarda le differenze riscontrabili tra le curve teoriche e i dati sperimentali di Pennes stesso. Queste differenze potevano essere accettate all'epoca di Pennes, poiché si trattava dei primi studi rigorosi sull'argomento, ma a più di cinquanta anni di distanza all'occhio di molti studiosi non risultano più credibili. D'altra parte i meriti degli studi di Pennes sono nell'approccio: le equazioni di bilancio sono di tipo lineare e perciò gli studi riguardanti i tessuti possono essere risolti con vari metodi comunemente utilizzati nei casi di conduzione del calore. Per quest'ultimo motivo l'equazione di Pennes oggi è universalmente riconosciuta come equazione del calore umano ("bioheat equation").
Benché ovunque l'equazione del calore umano sia stata applicata e abbia portato ad un accordo tra dati teorici e dati sperimentali, la sua validità è sempre rimasta dubbia. Per questo motivo Wissler ha cercato di chiarire una volta per tutte i dubbi riguardanti questa equazione.
Richiami teorici
Nel capitolo 1 è stata trattata ampiamente l'equazione di Pennes, sono riportati in questo paragrafo brevemente i risultati teorici per chiarezza. L'idea fondamentale di Pennes è stata di considerare il flusso termico attraverso una regione proporzionale alla perfusione sanguigna e la differenza tra la temperatura arteriosa e quella locale dei tessuti:
| ` h_b = V rho_b c_b (kappa - 1) (T - T_a) ` | (55) |
Dove hb è il flusso di calore per unità di volume, V6 rappresenta la perfusione sanguigna, ` rho_b ` è la densità del sangue, ` c_b ` è il calore specifico del sangue, e ` kappa ` è un fattore compreso tra 0 e 1 che tiene conto del disequilibrio termico tra sangue e tessuti, ma che generalmente viene considerato pari a 0. Ta rappresenta la temperatura del sangue arterioso, mentre T quella dei tessuti; da qui in poi considereremo ` w=V rho_b c_b `.
Il bilancio termico, quindi, è:
| ` rho c {del T} / {del t} = k grad^2 T + h_m + h_b ` | (56) |
c e ` rho ` si riferiscono ai tessuti, k è la conduttività termica dei tessuti, e hm rappresenta la produzione di calore da parte del metabolismo.
La risoluzione della 56 viene effettuata da Pennes in coordinate cilindriche:
| ` T(r) = { (T_s - b/a) I_0 (sqrt(a) r) } / { I_0 (sqrt(a)R) } + b/a ` | (57) |
Dove I0 è una funzione di Bessel di ordine 0, e
` a = w/k `
` b= {w T_a + h_m} / k `
Dall'equazione 57 segue:
| ` {T(r) - T_s} / {T_0 - T_s} = { I_0 (sqrt(a) r ) - I_0 (sqrt(a) R) } / { I - I_0 (sqrt(a) R) } ` | (58) |
Avendo indicato con T0 la temperatura lungo la linea media dell'arto. L'equazione 58 può essere riscritta in un'altra forma:
| ` bar T(bar r) = {I_0 ( omega bar r) - I_o omega } / {1 - I_0 omega} ` | (59) |
Con
| ` bar T = {T(r) - T_s } / {T_0 - T_s} ` | (60) |
| ` omega = sqrt( {w R^2 } / k ) ` | (61) |
| ` bar r = r / R ` | (62) |
Sia ` bar T, omega, bar r ` sono tutti valori adimensionali.
Risultati sperimentali
Le misure compiute Pennes per ottenere la distribuzione di temperature interne all'avambraccio sono visualizzate dalla Fig. 16 a pag. 32. Si vede chiaramente che esse sono alquanto differenti da soggetto a soggetto, a causa, principalmente, della differente perfusione sanguigna. Nella Fig. 17 di pag. 36, vengono esposte sia la curva media sperimentale che la curva teorica di Pennes, il metodo su come abbia ottenuto la curva media sperimentale rimane molto oscura, poiché le uniche informazioni a riguardo sono le parole di Pennes stesso: "la curva sperimentale è ottenuta come media delle curve sperimentali [Fig. 16] riportate per un avambraccio di 4 cm di raggio". Questa affermazione lascia spazio a svariate interpretazioni.
Per chiarire come possa aver ottenuto la curva sperimentale Wissler ha ipotizzato che Pennes abbia normalizzato i dati, posti nell'equazione 59, moltiplicando r per 4/R, dove R rappresenta il raggio del particolare individuo. Sfortunatamente questa assunzione non vale, perché seguendo questa strada le temperature sulle superfici estreme dell'avambraccio, per ` r= +- 4 c m ` , risultano più basse di almeno 0,9 °C. Però aver ottenuto, normalizzando le distanze, delle temperature inferiori a quelle ottenute da Pennes fa supporre che egli abbia utilizzato temperature sottocutanee. Questa intuizione ha portato Wissler a immaginare che Pennes, una volta individuata la linea media dell'asse del braccio, abbia considerato e riportato solo le temperature fino a 4 cm dal punto medio, disinteressandosi se queste fossero ancora all'interno del braccio, oppure sulla superficie.
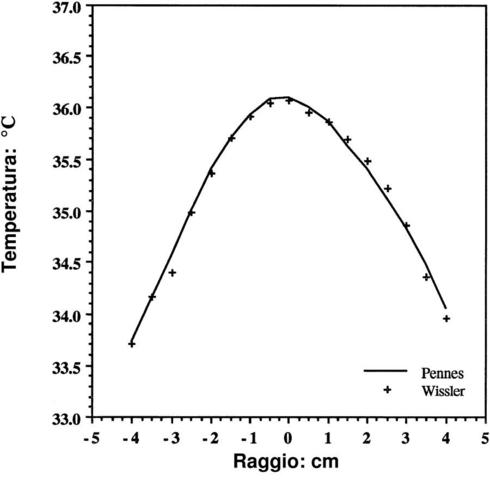
Fig. 27 Con linea continua: curva media sperimentale di Pennes. Con segno + i dati ottenuti da Wissler
Nella Fig. 27 sono riportati, con il segno più, i dati ottenuti da Wissler attraverso quest'ultimo metodo, si vede che sono molto prossimi alla curva ottenuta da Pennes, ciò fa credere che sia stato questo il metodo, ma non dà l'assoluta certezza.
Un'analisi alternativa dei dati di Pennes
Se il metodo dedotto da Wissler è esatto, allora comparare la curva media sperimentale di Pennes con la curva teorica è inappropriato. L'equazione 59 suggerisce che il rapporto ` bar T = {T(r) -T_S} / {T_O -T_S} ` debba essere funzione del raggio ` bar r = r/R ` normalizzato e del parametro adimensionale ` omega `. In questo modo la rappresentazione sarebbe indipendente dalla temperatura arteriosa Ta, dalla temperatura ambiente Te, dal coefficiente h e da hm.
In Fig. 26 sono mostrate le curve sperimentali normalizzate insieme alla curva teorica di Pennes per ` w= 0.0003 {c a l} / {c m^3 * s * °C} `.
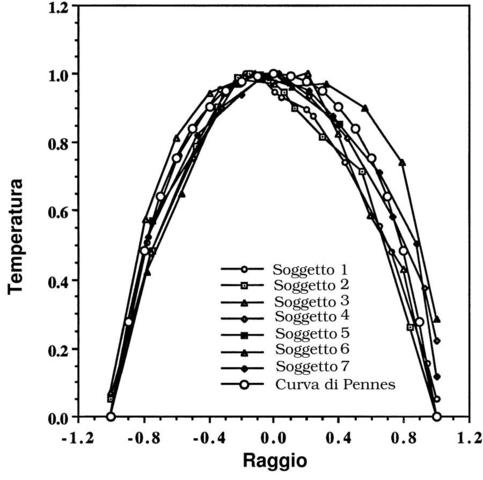
Fig. 28 Curve sperimentali normalizzate e curva teorica di Pennes. In ordinate 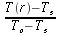 e in ascisse
e in ascisse 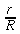
Si vede in maniera molto chiara che non vi è una forte discrepanza tra i dati teorici e quelli sperimentali, però prima di dare un giudizio conclusivo è meglio controllare più a fondo. In particolare bisogna controllare che i parametri usati da Pennes per ottenere la sua curva teorica siano ragionevoli. Inoltre non è sufficiente stabilire che la distribuzione di temperature all'interno dell'avambraccio abbia la forma corretta, ma la grandezza di questa precisione.
Valutazione dei parametri
Conduttività termica: Pennes ha utilizzato come valore ` 0.0005 {c a l}/{c m * s *°C}`, questa quantità è circa un terzo del valore comunemente accettato oggigiorno ` 0.0015 {c a l}/{c m * s *°C}`.
Coefficiente di trasmissione del calore:il coefficiente adottato da Pennes è pari a ` 0.0001 {c a l}/{c m^2 * s *°C}`. Da studi su corpi cilindrici immersi in aria ferma, il coefficiente h=hc+hr somma di quello per radiazione e per convezione, sarebbe più appropriato ` 0.0002 {c a l}/{c m^2 * s *°C}`. In questo caso il valore di Pennes eccessivamente basso.
Perfusione sanguigna: Pennes ha utilizzato i seguenti valori per la perfusione ` V rho_b = 0.0002 - 0.00025 - 0.0003 g / {m l * s} ` ` ( 1.2-1.5-1.8 {m l}/{100 m l * m i n} ) `, mentre dagli studi di Barcroft e Edholm si evince (v. Fig. 29) che il valore più adatto, oltre che maggiormente consigliato dai due studiosi, è ` 3.1 {m l}/{100 m l * m i n} `.
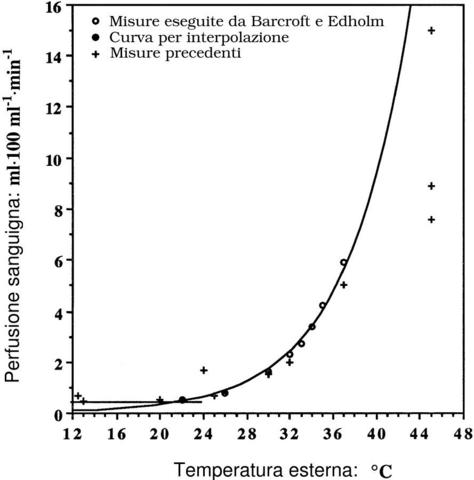
Fig. 29 Perfusione sanguigna media dell'avambraccio in funzione della temperatura esterna
Curva teorica alternativa
Con i dati fino ad ora osservati si può affermare che alcuni dei dati usati da Pennes sono alquanto discutibili, anche se la curva teorica ben si adatta con i dati sperimentali. I parametri utilizzati da Pennes sono confrontati con quelli standard usualmente utilizzati nella tabella sottostante.
| Parametro | Pennes | Standard | Unità |
|---|---|---|---|
| V | 1,5 | 3,0 | ` {m l}/{100 m l * m i n} ` |
| K | 0,0005 | 0,0015 | ` {c a l}/ {c m * s * °C} ` |
| Ta | 36,25 | 36,8 | °C |
| R | 4,5 | 4,5 | cm |
| ` omega ` | 3,18 | 2,64 | adimensionale |
Tabella 2 Valori dei parametri utilizzati da Pennes nel suo studio confrontati con quelli utilizzati oggigiorno.
Questi parametri sono influenzati direttamente dal valore di ` omega `, per cui è evidente la differenza tra le curve teoriche al variare di questo parametro. Nella Fig. 30 sono disegnate sia la curva di Pennes sia, entrambe normalizzate, la curva usando i valori standard, si nota chiaramente che nel campo di valori in questione la differenza risulta trascurabile.
Fig. 30 Curve normalizzate della distribuzione di temperatura all'interno dell'avambraccio, per due differenti valori di 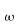 .
.
Conclusioni
Molti fattori hanno effetto sulla temperatura dell'avambraccio, per esempio non è un cilindro regolare, non è composto in maniera omogenea né è uniformemente perfuso dal sangue. Contiene due grandi ossa e un irregolare strato di grasso sottocutaneo, che ha proprietà fisiche differenti dai tessuti acquosi. Inoltre Pennes stesso afferma chiaramente che la distribuzione di temperatura dipende dai grandi vasi che irrorano i tessuti e dal metabolismo di quest'ultimi, quindi Ta non può essere presa come costante. Conseguentemente molti fattori potenzialmente significanti sono stati trascurati sia da Pennes che da Wissler. Alcuni di questi, come la geometria e la non omogeneità, sono facilmente correggibili, perché esistono molti metodi numerici validi per risolvere l'equazione di conduzione del calore. Altri come lo scambio tra vasi e tessuti non sono ancora così facilmente risolti, poiché mancano grandi quantità di dati sperimentali al riguardo.
Comunque, per concludere, lo studio condotto da Wissler ha levato ogni dubbio riguardo l'utilizzo della equazione di Pennes, lasciando però aperta la strada a successive modifiche, quando saranno disponibili metodi d'indagine termica, all'interno del corpo umano, non invasivi con sufficiente accuratezza; rendendo in questo modo disponibile una base di dati più ampia.
Bibliografia
- [1] Nathan Quinlan, 2002, Bioheat transfer, ME Heat Transfer, 404
- [2] Bazett e Love et al., 1948, Temperature changes in blood flowing in arteries and veins in man, J. Appl. Phys., 1, 3-19
- [3] Bazett e Mendelson et al., 1948, Percooling of blood in the arteries, effective heat capacity and evaporative cooling of the extremities, J. Appl. Physiol., 1, 169-182
- [4] Bruck e Hensel, 1953, Warmendurchgang und innentemperatur der menschlichen extremitaten, Arch. Ges. Physiol.,257, 70-86
- [5] Burton, 1934, The application of the theory of heat flow to the study of energy metabolism, J. Nutr., 7, 497-533
- [6] Burton e Edholm, 1955, Man in a cold enviroment, Baltimore, 5
- [7] Cooper e Edholm et al., 1955, The blood flow in skin and in muscle of the human forearm, J. Physiol London, 128, 258-267
- [8] Day, 1949, Regional heat loss, Physiology of heat regulation, Philadelphia, 240-261
- [9] Du Bois e Ebaugh et al. Basal heat production and elimination of thirteen normal women at temperature from 22°C to 35°C, J. Nutr., 48, 257-293
- [10] Hardy e Soderstrom, 1938, heat loss from the nude body and peripheral blood flow at temperatures of 22°C to 35°C, J. Nutr., 16, 493-510
- [11] Hatfield e Pugh, 1951, Thermal conductivity of human fat and muscle, Nature, 168, 918-919
- [12] Lefèvre, 1911, Chaleur animale et bionergetique, Parigi, 393-400
- [13] Lind e Humphreys et al., 1970, Effect of age on response to heat exposuree. J. Appl. Physiol., 28, 50-56
- [14] Lipkin e Hardy, 1954, Measurement of some thermal properties of human tissues, J. Appl. Phys., 7, 212-217
- [15] Mitchell e Myers, An analytical model of the countercurrent heat exchange phenomena, Biophys. J., 8, 897-911
- [16] Nielsen, 1969, Acta Physiol. Scand. Suppl, 323.
- [17] Pennes, 1948, Analysys of tissue and arterial blood temperatures in the resting huma forearm, J. Appl. Phys., 1, 93-122
- [18] Scholander e Krog, Countercurrent heat exchange and vascular bundles in sloths, J. Appl. Physiol., 10, 405-411
- [19] Schroder e Voridis, 1955, Uber innentemperatur, warmedurchgangszahl und spontanrhytmik der durch blutung der menschlichen hand, Arch. Ges. Physiol., 261, 550-556
- [20] Seiler, 1969, Augmented heat transfer through tissue due to blood flow and vascular interaction, University of Minnesota
- [21] Spealman, 1945, Effect of ambient air temperature and of hand temperature on blood flow in the hands, Am. J. Physiol., 145, 218-22
- [22] Winslow e Herrington, 1949, Temperature and human life, Princeton, 76
- [23] Wissler, 1966,A mathematical model of the thermal system, Chem. Eng. Pog. Symp. Ser., 62, 65-78
- [24] Wyndham, 1965, Role of the skin and of core temperature in man's temperature regulation, J. Appl. Physiol., 29, 31-36
- [25] Keller e Seiler, 1971, An analysis of peripheral heat transfer in man, J. Appl. Physiol., 30, 779-786
- [26] Wissler, 1998, Pennes' 1948 paper rivisited, J. Appl. Physiol, 85, 35-41
- [27] Barecroft e Edholm, The effect of the temperature on blood flow nd dep temperature in the human forearm, J Physiol (London), 102, 5-20
- [28] Barcroft e Edholm, 1942, Temperature and blood flow in the human forearm, J Physiol (London), 104, 366-376
- [29] Charny, 1992, Matematical models of bioheat transfer, Advances in Heat Transfer, New York
- [30] Lomholt, 1930, Unstersuchungen uber die warmeverteilung in der haut bei starker bestrahlung mit sichtbaren lichtstrahlen, Strahlentherapie, 35, 324-338
- [31] McAdams, 1942, Heating and cooling fluids outside tubes , Heat trasmission, New York
- [32] Wissler, 1958, The effect of lungitudinal conduction of heat on the cooling fonger, US Army Medical Research Laboratory Report No. 363, Fort Konx
- [33] Wissler, 1958, A formulation of finger rewarming by vasodilatation, US Army Medical Research Laboratory Report No. 364
- [34] Wissler, 1961, Steady-state temperature distribution in man, J. Appl. Physiol., 16, 734-740
Applicazioni
Introduzione
Verranno ora mostrate una serie di applicazioni riguardanti l'interazione tra tessuti e il calore. La trattazione dell'ipertermia verrà sviluppata abbondantemente nel prossimo capitolo. Le tecniche qui presentate sono tra le più recenti dell'ingegneria clinica.
Diagnosi precoce del tumore al seno utilizzando mappe termiche
Sommario
Le mappe termiche generate utilizzando apparecchiature TIR7 rendono possibile stabilire la presenza di tumori all'interno del seno. Sebbene il calore prodotto nei seni che arriva fino in superficie è ben modellizzato dall'equazione di Pennes, ottenere la soluzione per il problema inverso è impraticabile a causa delle condizioni al contorno eccessivamente complicate. Per questo motivo si preferisce rifarsi ad una analogia elettrica, che permetta di capire non solo le vie seguite dal calore per arrivare in superficie, ma anche aiuti a studiare le attività metaboliche all'interno dell'organismo.
Questa tecnica ha ottenuto i risultati ricercati e viene utilizzata tuttora in alcuni ospedali degli stati uniti.
Immagini termiche
Uno dei grandi vantaggi dell'uso delle immagini termiche risiede nella possibilità di non avere contatto fisico con l'oggetto della misura. Le immagini termiche TIR misurano il calore emanato da una fonte di calore trasportato dalla radiazione. La radiazione infrarossa occupa una regione dello spettro elettromagnetico tra il visibile (4*1014 Hz) e le microonde (3*1011 Hz). Tutti corpi dell'universo emettono radiazione come funzione della loro temperatura. Più un corpo diventa caldo, più la radiazione emessa diventa intensa e la lunghezza d'onda della radiazione diventa piccola [3]. L'occhio umano non è in grado di percepire la radiazione infrarossa, ma si può misurare con particolari telecamere e sensori.
Oggi l'impiego di strumenti capaci di percepire l'infrarosso percorre campi notevolmente diversi: militare, industria meccanica e medicina moderna. Non è invasiva e non è distruttiva, perciò sta diventando uno strumento sempre di maggior pregio per la diagnosi.
I primi studi sull'impiego delle immagini termiche le possiamo trovare nell'articolo di Williams e Handley pubblicato su "Lancet" del 1961 [6]. Sfortunatamente l'uso di questa tecnica in maniera prematura e incontrollata la portò ad una fine precoce, perché negli anni 70 una serie di falso-positivo nella diagnosi del tumore alla mammella la mise in cattiva luce, e fu sconsigliata come metodica di diagnosi [4]. Successivamente, al contrario di altri campi, nella medicina fu totalmente abbandonata.
A distanza di trent'anni la diagnosi all'infrarosso riappare in medicina per le seguenti ragioni:
- La tecnologia dell'infrarosso è migliorata, sono ora disponibili telecamere più accurate e sensibili.
- Si hanno a disposizione migliori capacità per elaborare le immagini. Su un qualunque computer moderno è possibile migliorare l'immagine, modificarla, segmentarla e ripristinarla all'originale dopo averla manipolata.
- Abbiamo una conoscenza più profonda delle relazioni tra risultati all'infrarosso e stati patofisiologici.
L'ultimo punto è di fondamentale importanza poiché, al contrario di altre tecniche come i raggi x e tomografia computerizzata (CT) che forniscono una immagine diretta della struttura dell'organismo, le immagini all'infrarosso debbono essere elaborate con particolare attenzione, poiché danno notizie della temperatura del flusso sanguigno e del sistema nervoso; senza una profonda conoscenza dei fenomeni di diffusione termica all'interno dell'uomo, l'analisi dei dati risulterebbe sbagliata. In linea teorica risolvendo l'equazione di Pennes si può risalire dalla distribuzione sulla superficie, alla distribuzione del calore all'interno del corpo umano; la complessità delle condizioni al contorno, però, scoraggia tale strada, anche se corretta sotto ogni punto di vista [1, 2]. Risulta allora più comoda da un punto di vista pratico ricorrere ad un'analogia elettrica, ideata dal professor Hairong Qi [7]. Questa metodologia ha dato i risultati sperimentali sperati, e risulta notevolmente più semplice che ricorrere alla risoluzione agli elementi finiti dell'equazione di Pennes.
L'analogia elettrica
Le cellule viventi di un qualunque organismo sono sede di attività metabolica, questa attività, che sia di tipo biochimico o di tipo fisico, genera calore. Per questo motivo il calore sulla superficie di un organismo può riflettere il tasso metabolico.
La termografia tradizionale cerca di trovare delle anomalie nella mappa termica di un individuo, poiché in quelle zone il metabolismo delle cellule dovrebbe essere alterato come accade per le cellule tumorali [5].
Fig. 31 Analogia termoelettrica.
Considerando la Fig. 31, la fonte di calore S può essere schematizzata come una batteria di voltaggio Us; la perdita di calore all'interno della sorgente è raffigurata dalla resistenza Rs. Da questo punto di vista la differenza di potenziale della sorgente rappresenta la sua temperatura, e il flusso di calore viene rappresentato dalla corrente elettrica. Similmente si può schematizzare come fonte di calore l'aria esterna al corpo, e quindi far corrispondere i rispettivi Ua e Ra.
Il tessuto tra la fonte di calore interna e l'aria viene schematizzato come una serie di filtri passa basso. Il circuito in Fig. 31 mostra l'analogia per una sola linea di radiazione, se viene considerato il tessuto omogeneo, ma questa ipotesi è valida solo per lo studio del seno, allora il modello percepito dalla telecamera all'infrarosso ha una distribuzione secondo una Gaussiana (v.Fig. 31). La temperatura superficiale H(x,y) corrisponde al voltaggio U(x,y) e può essere calcolata con la seguente equazione:
| ` U(x,y)= U_s - {sum_{i=1}^n R_i } / {R_s + R_a + sum_{i=1}^n R_i} * (U_s - U_a)` | (63) |
Con ` n=[ D / {R_0 * cos alpha}]_{max in NN} ` e ` alpha = a r c t a n D/{sqrt(x^2 + y^2)} `.
La notazione indica che n è il più grande intero tra zero e il valore fra parentesi quadre, in questo modo si determina il numero di resistori interni, D è la profondità della fonte di calore e R è il tasso di resistenza al calore in un certo mezzo. I valori di R sono riportati nella Tabella 3.
| Parte del corpo | R |
|---|---|
| Tessuto adiposo | 0.1-0.15 °C/cm |
| Muscolo | 0.2 °C/cm |
| Osso | 0.3-0.6 °C/cm |
Tabella 3 Resistenza al calore per differenti parti del corpo.
Stima della profondità della fonte di calore
Per calcolare la profondità di una sorgente di calore si ipotizza che la distribuzione di temperatura superficiale, sia una Gaussiana (v. Fig. 31 e Fig. 32). La curva di Gauss ha la notevole proprietà di possedere due punti simmetrici, chiamati di mezza potenza, che dividono la potenza racchiusa sotto la curva in due parti di stesso valore.
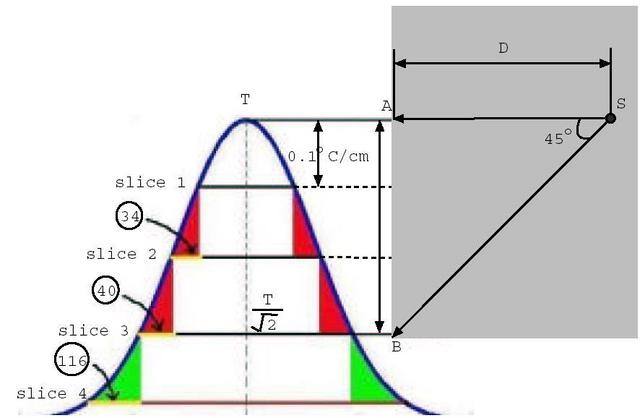
Fig. 32 Illustrazione dei punti di mezza potenza e del calcolo della profondità della sorgente di calore
Utilizzando l'equazione 63 con i valori della Tabella 3 si ottiene un valore dell'angolo ` alpha ` pari a ` pi / 4 `, in questa maniera il triangolo SAB, con ` bar {S A} = bar {A B} `, risulterà rettangolo. ` bar {S A} ` rappresenta la profondità della fonte di calore, mentre ` bar {A B} ` la distanza fra il punto di massimo e quello di mezza potenza. Quindi misurando la distanza fra il punto di picco della temperatura e quello di mezza potenza si ottiene automaticamente la profondità del tumore.
Per trovare i punti di mezza potenza, sempre facendo riferimento alla Fig. 32, si analizza l'immagine della temperatura superficiale, evidenziando i punti (pixel) al di sopra di una temperatura si ottiene una sezione dell'immagine con pochi pixel, se poi si evidenziano i punti al di sopra di una temperatura leggermente più bassa della precedente, la sezione aumenta di lievemente di dimensione ma non si notano grandi cambiamenti fino al punto di mezza potenza. Nella figura l'incremento relativo fra il raggio della prima sezione e quello della seconda è di 34 pixel, e di 40 pixel fra la seconda e la terza; ma tra la terza e la quarta, passando per il punto di mezza potenza vi sono ben 116 pixel. Ogni sezione della curva (v. anche Fig. 33) corrisponde ad una diminuzione di 0.1°C, per questo tipo di applicazione si può dire che esiste una resistenza al calore del tessuto adiposo, quindi per una variazione di 0.1°C occorre 1cm. In questo modo sezionando la curva a determinati intervalli si può trovare un elemento che produce calore con un accuratezza del centimetro.
Fig. 33 Esperimento di laboratorio utilizzando grasso di maiale al posto del tessuto adiposo umano.
Analisi dei risultati sperimentali
Oltre che a misurare la profondità di una sorgente di calore, sezionare la curva della temperatura rivela anche la crescita8 della forma seguita dai massimi di temperatura; facendo riferimento alla Fig. 33 i punti di massima temperatura vengono indicati anche "pixel bianchi". Tessuti differenti hanno crescite che seguono percorsi differenti. Per esempio i pixel dei linfonodi e dei tumori hanno una crescita a cerchi concentrici, mentre la crescita dei vasi sanguigni è longilinea lungo la loro direzione.
E' stato stilato un protocollo per la diagnosi, che prevede di eseguirla in sei passi:
- Analisi della crescita dei linfonodi nelle ascelle
- Misura di aree anormali
- Forma delle aree anormali
- Analisi dei percorsi vascolari
- Analisi dei capezzoli e relative areole
- Analisi dinamica con agenti esterni (antibiotici, ecc.)
Prendendo il primo punto come esempio, se i linfonodi nelle ascelle mostrano la presenza di una fonte di calore a una profondità minore di 2cm allora verrà posto un segno di anormalità (+); se due fonti di calore appaiono ad una profondità minore di 2cm e una differenza di temperatura maggiore di 0.2°C allora verranno registrati due segni di anormalità (++).
La Fig. 34 mostra una paziente con un carcinoma lobulare al seno sinistro.
Fig. 34 Sezioni successive di una paziente con un carcinoma nel seno sinistro.
Sezionando si notano i seguenti segni di anormalità:
- Un tumore di 2 cm circondato da 4 vasi (+++)
- Pixel bianchi circondano il capezzolo in 3 sezioni (+++)
- La differenza della temperatura bilaterale è di 0.8°C (+)
La Fig. 35 mostra una paziente con un carcinoma linfatico al seno sinistro.

Fig. 35 Diverse sezioni con una paziente affetta da un carcinoma linfatico.
I segni di anormalità riscontrati sono i seguenti:
- Differenza di temperatura bilaterale di 0,8°C (++++)
- Il tumore è a 2 cm dalla superficie (++)
- Il tumore è circondato da 5 vasi sanguigni (+++)
- Meno di tre sezioni sono necessarie per visualizzare pixel bianchi attorno al capezzolo (++)
Questa metodologia di indagine è stata brevettata9, gli studi clinici hanno mostrato possibilità di miglioramento nella sensibilità e nella specificità. In Cina è stata approvata per l'analisi sia di tumore al seno che all'ovaio. Circa 400'000 pazienti sono stati sottoposti ad indagine negli ultimi 5 anni. Su 103 casi del Ville Marie Breast & Oncology Center in Canada nel 2002, 92 hanno fatto anche una mammografia, e la mammografia non è riuscita ad individuare 6 casi. Questa metodologia viene anche ap|licata per la determinazione dei tumori all'ovaio, sui 77 casi studiati da prof.Qi, l'indagine all'infrarosso a una percentuale di errore del 6%; mentre le metodologie più consolidate, come ultrasuoni e la tomografia computerizzata, variano dal 3% al 5% ma vi è necessità di contatto fisico e generalmente sono più dolorose.
Coagulazione con microonde utilizzando antenne sottili coassiali
Introduzione
La terapia della coagulazione con microonde (MCT) è usata principalmente per il trattamento del carcinoma delle cellule epatiche[1, 2]. Una sottile antenna inserita nel tumore produce il riscaldamento del tumore e la coagulazione della regione comprendente le cellule cancerose. Generalmente l'antenna viene alimentata da una potenza di decine di Watt; per coagulare le cellule debbono raggiungere almeno 60°C, mentre il tempo necessario alla coagulazione è di pochi minuti per ogni trattamento.
Oggi ci sono principalmente due problemi che devono essere superati per migliorare le applicazione per le antenne per microonde convenzionali. Il primo riguarda la grandezza della regione coagulata; infatti risulta ancora troppo poco estesa soprattutto nella direzione perpendicolare all'antenna. Dal punto di vista clinico bisognerebbe raggiungere una regione di almeno 3 cm di diametro. Il secondo è relativo alla forma della regione, troppo longilinea lungo la direzione dell'antenna inserita.
Per risolvere il primo problema generalmente si usano due tipi di schemi a matrice, di tipo parallelo e di tipo spezzato, composte da due antenne coassiali scanalate. Mentre il secondo introducendo le antenne coassiali dipoliche può essere brillantemente risolto.
Antenne coassiali scanalate
La Fig. 36 mostra la struttura dell'antenna coassiale con scanalatura. Questo tipo di antenna è composto da un cavo sottile coassiale e la punta del cavo è cortocircuitata [3]. Il conduttore esterno possiede una scanalatura circolare. Con Lts si indica la lunghezza dalla punta alla scanalatura. La frequenza di utilizzazione è di 2450 MHz per ogni antenna, come è usuale per questo tipo di applicazioni.
Fig. 36 Schema dell'antenna coassiale con scanalatura
Metodo di calcolo
L'analisi computerizzata per calcolare la distribuzione di temperatura attorno all'antenna viene esposta nel diagramma della Fig. 37.
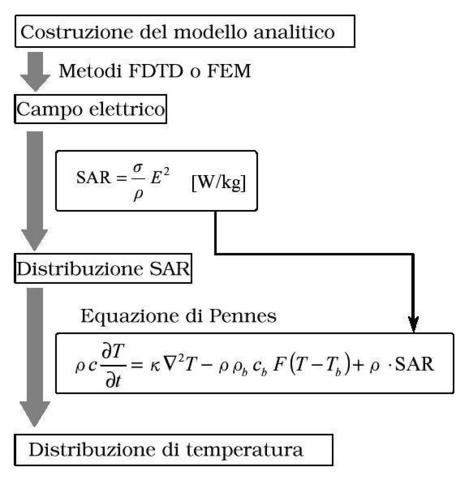
Fig. 37 Procedura per calcolare la distribuzione di temperatura attorno all'antenna.
Prima di tutto viene calcolato il campo elettrico attorno all'antenna usando il metodo delle differenze finite nel dominio del tempo (FDTD), oppure metodi agli elementi finiti (FEM) [4, 5].
Il passo successivo è di calcolare la distribuzione del tasso specifico di assorbimento (SAR) attorno all'antenna con:
` S A R = sigma / rho E^2 [W/{k g}] `
indicando con ` sigma ` la conduttività del tessuto ` [ 1/ {Omega * m} `, ` rho ` la densità del tessuto ` [ {k g} / m^3 ] ` e con E il campo elettrico (rms) [V/m]. Come si vede dalla formula la SAR è proporzionale al quadrato del campo elettrico, ed è equivalente al calore generato nei tessuti dal campo elettrico. La distribuzione SAR è una delle più importanti caratteristiche del riscaldamento attraverso le antenne.
L'ultima operazione da compiere per ottenere la distribuzione di temperatura nel tessuto attorno all'antenna, si può analizzare numericamente l'equazione di Pennes, includendo i valori ottenuti del SAR utilizzando il metodo alle differenze finite.
Riscrivendo il contributo del SAR nell'equazione di trasferimento del calore abbiamo:
` rho c {del T}/{del t} = k grad^2 T - rho rho_b c_b F (T-T_b) + rho S A R `
T rappresenta la temperatura innalzata [°C], t è il tempo [s], ` rho ` la densità del tessuto ` [{k g} / m^3] `, c il calore specifico del tessuto ` [J/{k g * K}] `, k la conduttività termica ` [J/{s*m*K}] `, ` rho_b ` la densità del sangue ` [{k g}/m^3] `, cb il calore specifico del sangue ` [J/{k g * K}] `, Tb la temperatura del sangue [°C] e F la portata in volume del sangue riferita all'unità di massa ` m^3/{k g * s} `.
Espansione della regione riscaldata attraverso l'applicazione a matrice
Applicazione di tipo parallelo
L'applicazione di tipo parallelo è composta da due antenne di tipo coassiale con scanalatura poste in parallelo; questa infatti è la matrice più semplice che esista.
La potenza fornita a ciascuna antenna è di 50 W, per un totale di 100 W; la temperatura iniziale del tessuto viene assunta pari a 37°C, il tempo di riscaldamento del tessuto è di 90 s, e la profondità di 70 mm.
Si preferisce usare in questo caso il metodo delle differenze finite nel dominio del tempo, la Fig. 38 mostra il suo spazio e i piani di osservazione.
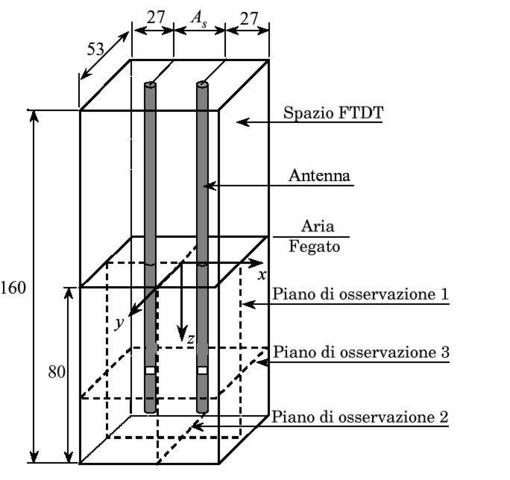
Fig. 38 Applicazione di tipo parallelo, spazio FTDT e piani di osservazione. Tutte le unità sono espresse in mm.
Si vede come Lts e As siano stati posti rispettivamente a 5 mm e 10 mm. Il piano di osservazione 1 è il piano x-z posto a y=0, il piano di osservazione 2 è il piano y-z a x=0, e il piano di osservazione 3 è il piano x-y dove la forma della regione coagulata si avvicina di più a quella di un cerchio.
Nella Fig. 39 si possono vedere le distribuzioni di temperatura secondo i tre piani.
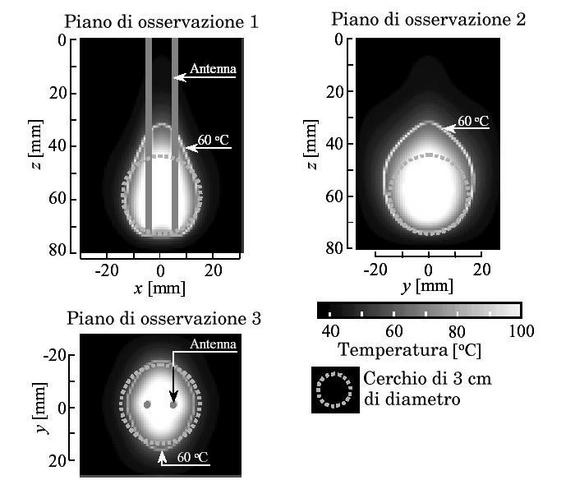
Fig. 39 Distribuzione di temperatura con applicazione di tipo parallelo.
E' stato disegnato, con linea grigia tratteggiata, sopra ogni piano di osservazione un cerchio del diametro di 3 cm. Si vede chiaramente l'area che arriva fino a 60°C copre interamente la sfera richiesta dalla cura clinica. Quindi il modello di tipo parallelo risulta adatto in terapia.
Applicazione di tipo spezzato
Questa applicazione è composta da due antenne del tipo coassiale con scanalatura, le cui punte possono essere divaricate una volta inserite all'interno del paziente. In questo modo è possibile diminuire il carico del paziente, seppur aumentando la complessità del modello.
Lo schema della struttura e per il calcolo FEM è visualizzato dalla Fig. 40.
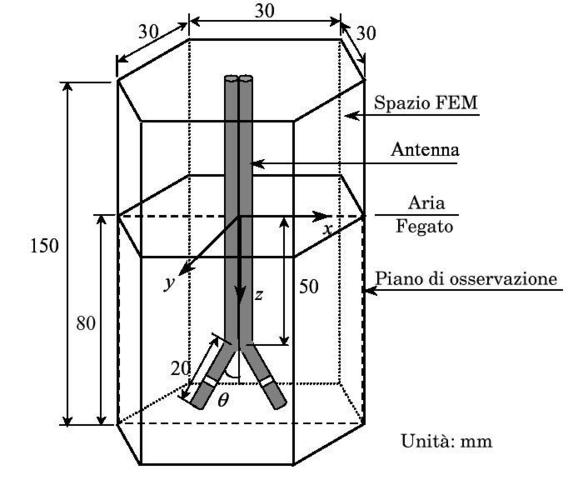
Fig. 40 Piano di osservazione e modellizzazione dello spazio per il tipo di applicazione spezzato.
In questo caso la lunghezza della parte di antenna divaricata è 20 mm, Lts è stato posto lungo 5 mm, 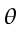 pari a 30°, la lunghezza dell'inserzione, misurandola dal punto in cui le antenne si separano, è di 50 mm. Il piano di osservazione risulta il piano x-z a y=0. Anche con questa applicazione si è mantenuta una potenza di 50 W per ogni antenna.
pari a 30°, la lunghezza dell'inserzione, misurandola dal punto in cui le antenne si separano, è di 50 mm. Il piano di osservazione risulta il piano x-z a y=0. Anche con questa applicazione si è mantenuta una potenza di 50 W per ogni antenna.
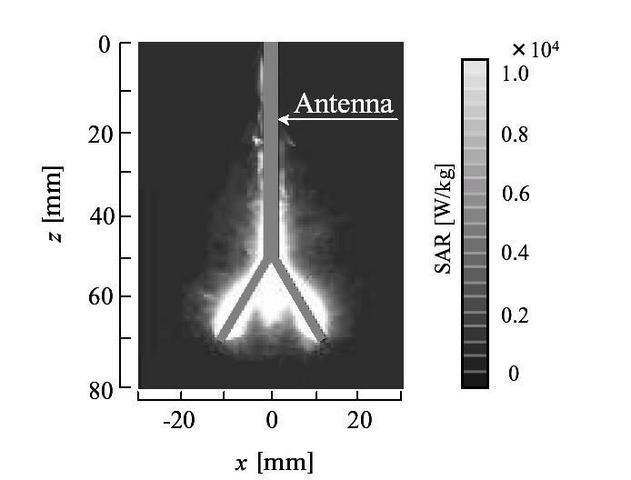
Fig. 41 Distribuzione SAR nel piano di osservazione.
In Fig. 41 viene mostrata la distribuzione SAR della coppia di antenne, si nota come venga erogata la potenza nelle punte generando una grande e uniforme zona di riscaldamento. Si può anche notare come si generi del calore lungo l'inserzione dell'antenna; questo effetto, riscontrato in tutte le apparecchiature utilizzate normalmente, è un problema, poiché si coagulano anche zone sane. Per superare questa difficoltà si è pensato di utilizzare antenne coassiali dipoliche.
Antenne coassiali dipoliche
Lo scopo dello studio di questo tipo di antenne è di riuscire a sviluppare la potenza solo sulla punta di esse. La Fig. 42 mostra come sono costruite: esternamente ad una antenna coassiale con scanalatura vengono posti due cilindri cavi conduttori, chiamati maniche, ognuno di essi è in contatto con uno dei lati della scanalatura. Nel caso specifico la lunghezza delle maniche è di 20 mm.
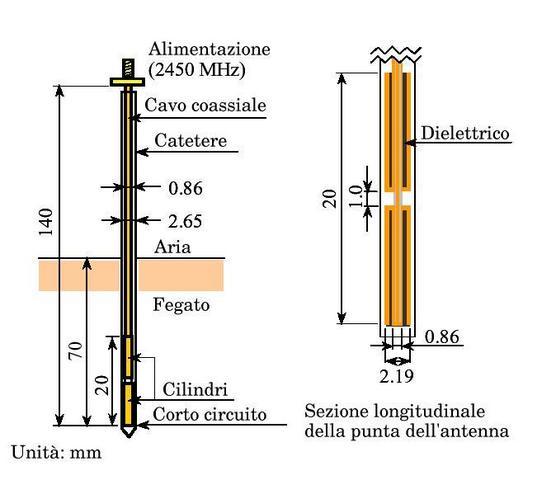
Fig. 42 Antenna coassiale dipolica.
Sede teorica: calcolo FTDT
Per lo studio della distribuzione SAR nelle antenne dipoliche si è fatti ricorso ai metodi delle differenze finite nel dominio del tempo.
La distribuzione ottenuta è disegnata in Fig. 43, si nota come la potenza erogata più concentrata sulla punta rispetto alla normale applicazione con antenna scanalata.
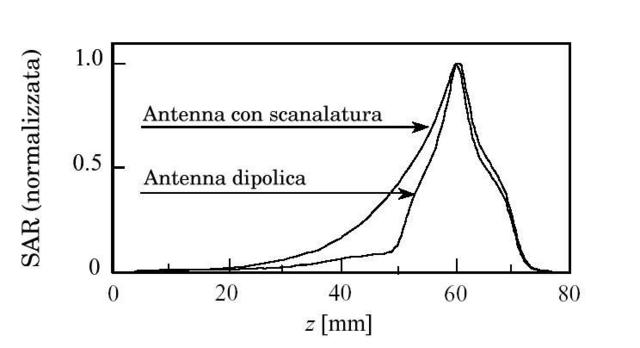
Fig. 43 Distribuzione SAR lungo l'asse dell'antenna.
Sede sperimentale: coagulazione
Per gli esperimenti si è seguita la procedura raffigurata in Fig. 44. Prima di tutto si è inserita una antenna dipolica in un fegato di maiale a circa 30°C. Successivamente si è riscaldato il fegato di maiale con l'antenna per 90 secondi. Dopo il riscaldamento, sezionando il fegato, si è osservata la regione coagulata.
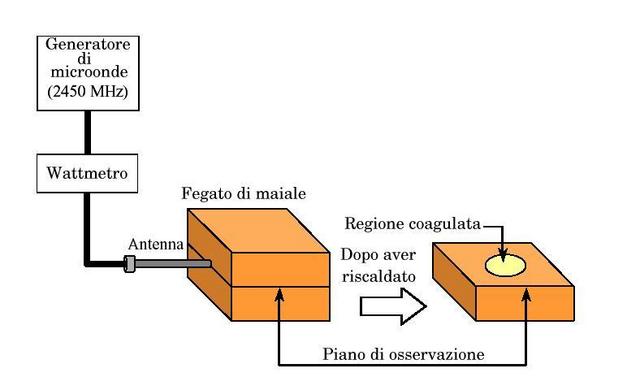
Fig. 44 Organizzazione dell'esperimento.
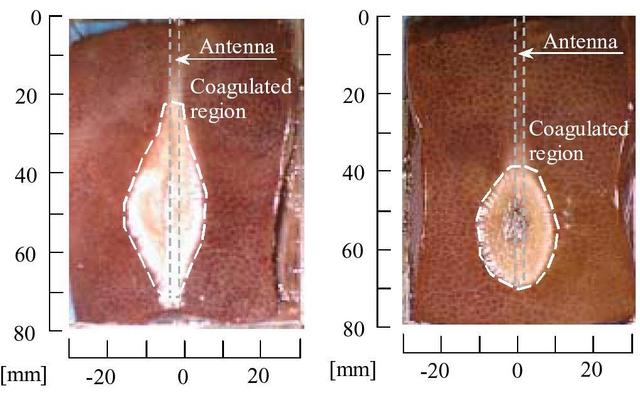
Fig. 45 Risultati sperimentali: a sinistra con antenna scanalata, a destra con antenna dipolica.
Nella Fig. 45 vengono mostrate due tipi di coagulazioni: a sinistra dovuto ad una antenna scanalata usuale, in cui possiamo riconoscere la tipica forma allungata nella direzione dell'antenna. A destra invece vediamo la coagulazione fornita da un'antenna dipolica, la lunghezza della coagulazione è approssimativamente la metà, dimostrando la sua utilità in campo medico.
Per migliorare ancora gli effetti dell'antenna dipolica bisognerebbe studiare le applicazioni a matrice, in modo da ingrandire la zona di coagulazione, come si è fatto per l'antenna scanalata. Nel compiere questi studi si è visto che utilizzare il modello FTDT produce meno errori, ma l'applicazione di tale metodo risulta estremamente complicato con matrici di antenne, quindi gli attuali studi cercano di riuscire ad elaborare un modello sufficientemente approfondito.
Modellizzazione degli abiti che proteggono dall'esposizione diretta del fuoco
Introduzione
In questo paragrafo verrà mostrato un modello analitico che predice il calore trasmesso attraverso abiti e aiuta a migliorare la protezione in ambiente con temperature intense. L'obbiettivo a breve termine è di sviluppare un sistema matematico che simuli i trasferimenti di massa e calore attraverso un singolo strato di tessuto esposto da un lato al fuoco vivo. Dal modello generalizzato si esporrà la validazione utilizzando il sistema di analisi "Pyroman".
Modello matematico
Il modello utilizzato è quello di Torvi, che considera il calore spostarsi attraverso tessuto, intercapedine d'aria, pelle (v. Fig. 46).
Questo schema assume molte semplificazioni:
- Processo di trasporto monodimensionale.
- Mancanza di trasferimenti di massa nell'intercapedine.
- Approccio semplificato nei cambianti di tipo chimico riguardante i tessuti.
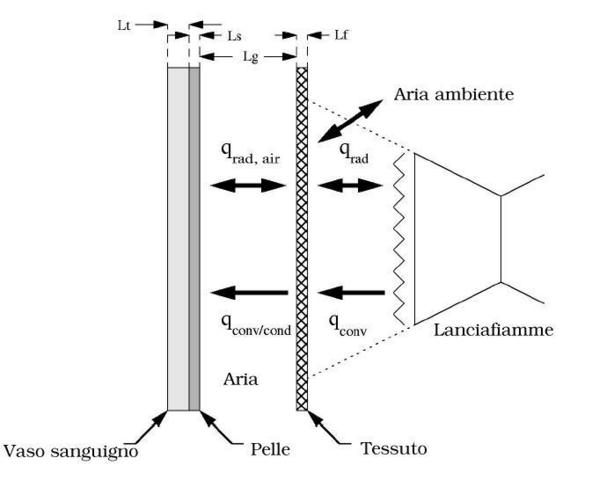
Fig. 46 Schematizzazione del trasferimento di calore dai vestiti al corpo umano.
Il flusso di calore di tipo convettivo si applica solamente alla superficie del tessuto, mentre il flusso termico per radiazione può penetrare nel tessuto fino ad un certo spessore. Per i motivi sopra descritti l'equazione di bilancio dell'energia, scritta in forma differenziale è:
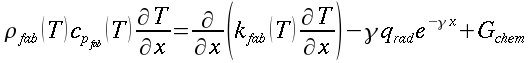 | (64) |
Il pedice "fab" indica la stoffa, quindi 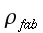 è la densità della stoffa;
è la densità della stoffa; 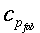 rappresenta il calore specifico del tessuto;
rappresenta il calore specifico del tessuto; 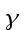 è il coefficiente di estinzione del tessuto, che può essere determinato attraverso la trasmissività
è il coefficiente di estinzione del tessuto, che può essere determinato attraverso la trasmissività 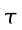 e lo spessore
e lo spessore 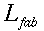 ,
,  .
. 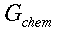 è l'energia generata dalle reazioni termochimiche nella stoffa,
è l'energia generata dalle reazioni termochimiche nella stoffa, 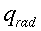 è il flusso di calore della radiazione incidente sulla superficie esterna del tessuto, data da:
è il flusso di calore della radiazione incidente sulla superficie esterna del tessuto, data da:
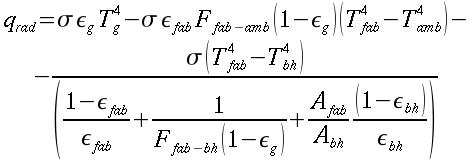 | (65) |
Nell'equazione 65 si indica con 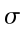 la costante di Stefan-Boltzmann;
la costante di Stefan-Boltzmann; 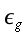 ,
, 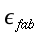 ,
, 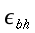 sono le emissività rispettivamente del gas caldo, del tessuto e della testa del lanciafiamme. Similmente
sono le emissività rispettivamente del gas caldo, del tessuto e della testa del lanciafiamme. Similmente 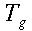 ,
, 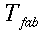 ,
, 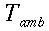 ,
, 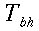 sono le temperature dei gas caldi, del tessuto, dell'aria ambiente e della testa del lanciafiamme. Mentre
sono le temperature dei gas caldi, del tessuto, dell'aria ambiente e della testa del lanciafiamme. Mentre  e
e 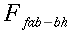 sono i fattori di forma che tengono conto la geometria del tessuto rispetto all'aria ambiente e alla testa del bruciatore; infine
sono i fattori di forma che tengono conto la geometria del tessuto rispetto all'aria ambiente e alla testa del bruciatore; infine 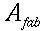 e
e 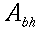 sono le aree delle superfici del tessuto e della testa del bruciatore.
sono le aree delle superfici del tessuto e della testa del bruciatore.
Le condizioni al bordo sono le seguenti:
sulla superficie esterna del tessuto (x=0), per t>0:
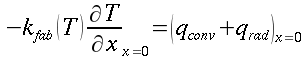
indicando con 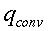 il flusso di calore convettivo tra tessuto e i gas caldi, dato da:
il flusso di calore convettivo tra tessuto e i gas caldi, dato da:
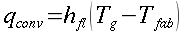
il pedice "fl" indica la fiamma del bruciatore.
All'interno del tessuto (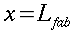 ), sempre per t>0, abbiamo:
), sempre per t>0, abbiamo:
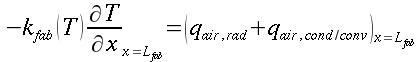
dove 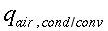 è l'energia trasferita per conduzione e convezione dal tessuto alla pelle umana attraverso l'aria racchiusa nell'intercapedine tra stoffa e corpo, questo valore è dato da:
è l'energia trasferita per conduzione e convezione dal tessuto alla pelle umana attraverso l'aria racchiusa nell'intercapedine tra stoffa e corpo, questo valore è dato da:
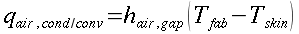
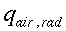 è invece l'energia trasferita per radiazione dal tessuto alla pelle attraverso l'intercapedine, il suo valore è dato da:
è invece l'energia trasferita per radiazione dal tessuto alla pelle attraverso l'intercapedine, il suo valore è dato da: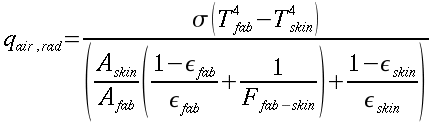
a questo punto i simboli utilizzati dovrebbero essere chiari.
Il modello utilizzato per rappresentare il trasferimento di calore nei tessuti viventi è quello di Pennes, quindi:
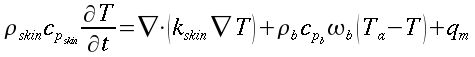
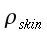 è la densità della pelle umana,
è la densità della pelle umana, 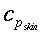 è il calore specifico della pelle umana,
è il calore specifico della pelle umana, 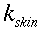 è la conduttività termica della pelle umana,
è la conduttività termica della pelle umana, 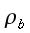 è la densità del sangue,
è la densità del sangue, 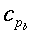 è il calore specifico del sangue,
è il calore specifico del sangue, 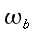 è la perfusione sanguigna,
è la perfusione sanguigna, 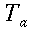 è la temperatura arteriosa e
è la temperatura arteriosa e 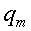 è il calore per unità di volume dovuto al metabolismo.
è il calore per unità di volume dovuto al metabolismo.Le condizioni al contorno sulla superficie della pelle 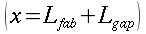 sono:
sono:
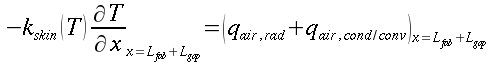
Mentre le condizioni sul vaso sanguigno 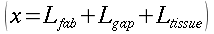 , per t>0:
, per t>0:
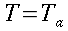
La condizione iniziale è data dalla distribuzione di temperatura a t=0. In aggiunta a ciò, la temperatura del tessuto è assunta inizialmente uniforme:
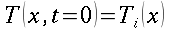
Utilizzando il metodo Torvi si è riusciti a stabilire gli effetti dei vapori, le degradazione termiche dei tessuti tessili, ecc. L'approccio numerico scelto è quello delle differenze finite, per predire le temperature i flussi di calore attraverso la simulazione delle condizioni fuoco vivo. Le proprietà del tessuto e della pelle sono ritenute costanti al variare della temperatura e del tempo. La pelle viene divisa in tre strati: epidermide, derma e regioni sottocutanee; la perfusione sanguigna viene inclusa solo nelle ultime due regioni. Questo schema molto semplificato viene utilizzato per risolvere le equazioni differenziali nel dominio del tempo, nel futuro potranno essere elaborati schemi più complessi per ottenere modelli più precisi e realistici.
La Fig. 47 mostra i risultati del modello matematico. Si vede che la distribuzione di temperatura attraverso:
- un singolo strato di tessuto, del tipo Nomex®IIIA
- l'intercapedine d'aria
- la pelle umana
sviluppata attraverso un'esposizione al calore di 2 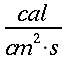 .
.
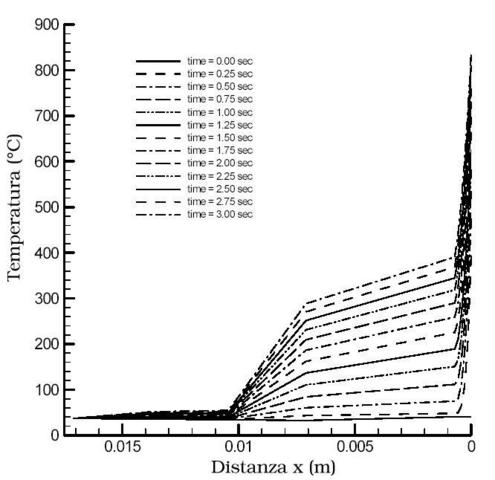
Fig. 47 La distribuzione di temperatura attraverso la pelle, l'intercapedine d'aria, e il tessuto.
Studio delle condizioni al contorno
Lo stato dell'arte per la valutazione della qualità delle vesti protettive è il sistema di valutazione per protezioni termiche "Pyroman" . Pyroman® è un manichino che possiede al suo interno e sulla superficie tutta una serie di sensori termici, posto in una camera attrezzata con un sistema capace di generare l'equivalente del fuoco vivo con una esposizione controllata.

Fig. 48 Pyroman: a sinistra il manichino nudo, a destra il sistema in azione con il manichino incendiato.
Un sofisticato computer è usato per analizzare i dati che provengono dagli strumenti del manichino, provvedendo a fornire informazioni sull'intensità e la posizione di possibili ferite dovute al fuoco. La Fig. 48 mostra sia il manichino Pyroman nella camera che esposto al fuoco.
Per questi esperimenti, Pyroman è stato equipaggiato con speciali sensori progettati per misurare la temperatura dovuta alle fiamme e per stimare la distribuzione del flusso di calore dovuto al fuoco vivo 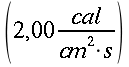 . Sono state usate per la misura della temperatura delle fiamme termocoppie di tipo B e R con un diametro di 0,0508 mm. Per misurare il flusso di calore è stata usata la termocoppia di tipo T. L'alloggiamento dei sensori termici è mostrato in Fig. 48.
. Sono state usate per la misura della temperatura delle fiamme termocoppie di tipo B e R con un diametro di 0,0508 mm. Per misurare il flusso di calore è stata usata la termocoppia di tipo T. L'alloggiamento dei sensori termici è mostrato in Fig. 48.

Fig. 49 A sinistra l'alloggiamento delle termocoppie, a destra il sistema di misura.
I sensori sono stati collegati ad un sistema di acquisizione dati LabView. Sempre in Fig. 49 è mostrato l'apparato di acquisizione con il sistema di controllo software LabView, i sensori sono stati collegati al proprio modulo e quindi ad una scheda DAQ all'interno del computer per il segnale in digitale.
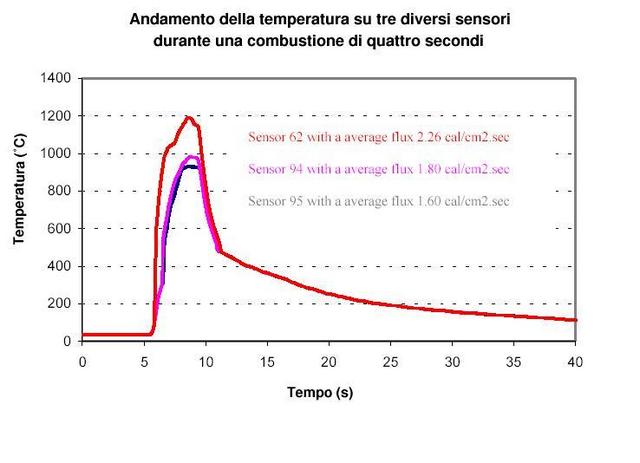
Fig. 50 Andamenti delle temperature su tre diverse termocoppie poste sul manichino Pyroman durante una combustione di soli quattro secondi.
La Fig. 50 mostra l'andamento della temperatura di sensori posti sul manichino Pyroman, la fiamma è stata alimentata per 4 secondi dopo la sua accensione. Il sensore 62 era posto all'altezza del petto, mentre il sensori 94 e 95 all'altezza della vita; le differenze di temperatura tra il primo e i secondi è di 200°C, mentre tra la termocoppia 94 e la 95 di 50°C. Queste forti differenze mettono in luce come il modello unidimensionale non sia assolutamente sufficiente, tenendo conto che l'esperimento, se fosse durato più tempo avrebbe mostrato scostamenti maggiori.
Per questi motivi si continua a investigare in diversi campi: lo sforzo maggiore in cui il team del North Carolina University si sta concentrando è di passare da un modello unidimensionale ad uno bidimensionale, e infine ad uno tridimensionale. Il secondo campo in cui gli studi proseguono è chiaramente di determinare tutti i cambiamenti termofisici del tessuto, esplorando gli effetti alle temperature più alte e soprattutto i tempi in cui i cambiamenti delle proprietà di questi indumenti di protezione. I dati così ottenuti sono essenziali per il miglioramento del modello matematico.
Sviluppando ulteriormente il modello sarà possibile predire il flusso di calore attraverso più strati di elementi protettivi, con lo sviluppo del modello tridimensionale si potrà capire meglio l'effetto della geometria della protezione rispetto al fronte di fiamma. Infine si cerca anche di migliorare il modello Pyroman, sia cercando di utilizzare sensori sempre più precisi e adatti alle misure in questione, ma anche nei materiali che costituiscono il manichino e la loro interazione con gli oggetti degli esperimenti.
Criochirurgia
Introduzione
La criochirurgia, si occupa della distruzione di tessuti indesiderati attraverso il congelamento, è conosciuta come trattamento chirurgico fin dal 1845, quando James Arnott espose un tumore della pelle ad una soluzione salina parzialmente congelata, a circa -22°C[10]. Essa però è stata applicata effettivamente come trattamento per gli organi interni nel 1961, quando Cooper e Lee presentarono il primo criostato per applicazioni cliniche[7]. Il criostato era definito come una sonda raffreddante che generava un foro freddo, oggi è conosciuto da tutti come criobisturi. Il primo criobisturi è stato progettato per trattare i tumori del cervello e parti del cervello associate alla sindrome di Parkinson[14]. Negli anni la criochirurgia è stata applicata su una grande varietà di tumori e di altri tessuti non desiderati, spaziando dal cervello fino alla rimozione dei tatuaggi. Il concetto di criochirurgia come procedura minimamente invasiva, utilizzando più criobisturi si è formato a metà degli anni ottanta, come conseguente sviluppo delle immagini cliniche, principalmente attraverso gli ultrasuoni e la risonanza magnetica (MRI)[12, 16, 25].
La chirurgia prostatica è stata la prima procedura criochirurgica minimamente invasiva a passare dallo stato sperimentale a quello di trattamento chirurgico di routine[17]. L'approccio non invasivo, o minimamente invasivo, ha creato una nuova difficoltà, poiché bisogna operare avendo chiara la forma tridimensionale di ciò che deve essere eliminato per preservare i tessuti circostanti. Per superare questa difficoltà, si è pensato dal 1994[2] di utilizzare almeno cinque o sei criobisturi contemporaneamente, basandosi sugli effetti del raffreddamento con azoto liquido. Con i recenti sviluppi riguardanti l'effetto Joule-Thompson, il diametro del criobisturi è sceso notevolmente, per migliorare ulteriormente il controllo durante l'operazione si è arrivati ad utilizzare contemporaneamente più di dodici criobisturi. Sebbene sia noto che l'effetto Joule-Thomson generi un raffreddamento minore rispetto all'azoto liquido, infatti le temperature raggiunte durante un'operazione dal criobisturi ad effetto Joule-Thomson sono più alte di quelle ad azoto liquido, si preferisce utilizzare il primo perché il numero di criobisturi utilizzabili contemporaneamente è notevolmente più alto.
Con l'aumento sempre più spinto dei criobisturi una nuova sfida si è affacciata nella criochirurgia: come modellare la zona congelata secondo le esigenze mediche e limitare gli effetti del congelamento nelle aree limitrofe. Un buon esempio di strumento che permette di limitare il congelamento preservando i tessuti desiderati è il riscaldatore uretrale, usato nella criochirurgia prostatica. Tecnicamente il riscaldatore uretrale è uno scambiatore di calore ad acqua in controcorrente, infilato in un catetere normale. L'acqua, partendo da una riserva ad una temperatura prossima a quella corporea, è pompata attraverso il catetere per mantenere l'uretra ad una temperatura al di sopra del congelamento dei tessuti. Il riscaldatore uretrale ha dimostrato la sua efficacia nel minimizzare le complicazioni post operatorie associate ai danni all'uretra[6]. Sfortunatamente il riscaldatore uretrale è l'unico riscaldatore disponibile per il controllo della criochirurgia, e le sue capacità di riscaldamento sono limitate; inoltre a causa del suo grande diametro e alla tecnica d'inserzione sono poche le crioprocedure a cui possa essere applicato.
In questo paragrafo verrà mostrata una nuova tecnica riguardante un sistema riscaldante che assiste la criochirurgia tridimensionale utilizzando più fonti di calore, al contrario del riscaldatore uretrale che è una singola fonte di calore; esso si basa su una cartuccia riscaldante controllata in temperatura, chiamata crioscaldatore10[21]. Il crioscaldatore è uno strumento complementare al criobisturi, ma dal tutto indipendente dalla tecnica criochirurgica.
Verranno descritti nel seguente ordine:
- l'installazione del crioscaldatore
- il test di fattibilità su una soluzione gelatinosa
- lo studio pilota utilizzando una simulazione al computer
in questa maniera sarà chiaro il ruolo del crioscaldatore nel controllo della criochirurgia.
Installazione del crioscaldatore
Un illustrazione schematica del crioscaldatore è data in Fig. 51. L'elemento riscaldante è composto da una resistenza elettrica, posto sulla punta di un lunga ago ipodermico. Un sensore di temperatura è posto sulla parete interna dell'ago a metà della resistenza elettrica. Esternamente, il crioscaldatore risulta simile al criobisturi per operazione non invasive, che è composto da un lungo ago ipodermico con una punta chiusa e affilata.
Fig. 51 Illustrazione dell'apparecchiatura relativa al crioscaldatore, esternamente risulta del tutto simile ad un criobisturi.
Il crioscaldatore è connesso ad un controllore con due connettori: uno per il sensore di temperatura, utilizzato come meccanismo di controllo, ed uno per alimentare elettricamente la resistenza. Il controllore di temperatura è collegato ad un alimentatore che fornisce la potenza elettrica a tutta la strumentazione.
A scopo dimostrativo è possibile utilizzare come controllore di temperatura un computer laptop, misurando la temperatura attraverso un'interfaccia usb. Il meccanismo di switch è un relè a stato solido attivato dallo stesso dispositivo usb. L'alimentazione è un normale alimentatore ±5 V / ±12 V preso dal case di un computer desktop.
Test di fattibilità
Per gli scopi del test di fattibilità, è stata allestita una strumentazione sperimentale composta da quattro criobisturi e un crioscaldatore, come mostrato dalla Fig. 52. In Fig. 53(a) si vede la posizione relativa fra criobisturi e crioscaldatore. Il piano della figura è quello perpendicolare agli assi dei bisturi. I criobisturi hanno un diametro esterno di 3 mm e utilizzano per raffreddare l'effetto Joule-Thomson. Per costruire il crioscaldatore è stato utilizzato normale cavo elettrico, avvolto attorno ad una anima non conduttiva; il cavo possedeva una resistenza globale di 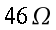 e un diametro esterno di 3 mm. La lunghezza della parte attiva sia dei criobisturi che del crioscaldatore è di 20 mm.
e un diametro esterno di 3 mm. La lunghezza della parte attiva sia dei criobisturi che del crioscaldatore è di 20 mm.

Fig. 52 Vista generica dei criobisturi e del crioscaldatore preparati per l'esperimento. I criobisturi sono della Galil-Medical (a effetto Joule-Thomson), essi hanno un diametro esterno di 3 mm. Il crioscaldatore sperimentale ha anch'esso un diametro esterno di 3 mm e una lunghezza attiva di 20 mm.
Il contenitore del test è di Plexiglas con pareti di 10 mm di spessore, e le dimensioni del volume contenuto al suo interno sono 20 x 200 x 200 mm3. Si noti che lo spessore del volume di prova è uguale alla lunghezza dei zone attive. A causa della bassa conduttività del Plexiglas, che è circa il 4% della conduttività termica dell'acqua ghiacciata, perciò il calore dovrebbe trasmettersi nel piano perpendicolare ai bisturi. Poiché questi bisturi in particolare non sono equipaggiati con dei sensori di temperatura, delle termocoppie di tipo T sono state connesse ai criobisturi, e la misura è stata presa attraverso l'interfaccia usb usata nel controllo (OMB55, Omega).
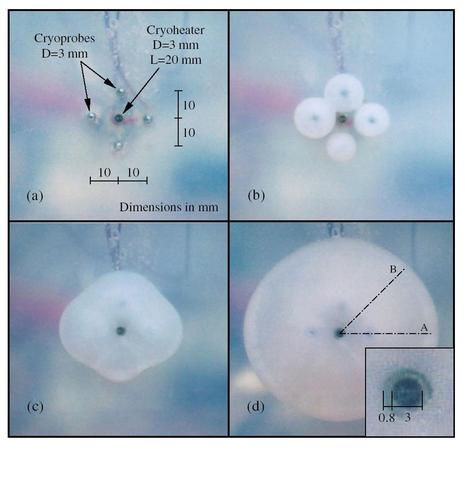
Fig. 53 Vista frontale dell'esperimento: a) prima che inizi il test. b) dopo un minuto. c) dopo 4 minuti. d) dopo 10 minuti. Le sezione A e B si riferiscono alle distribuzioni di temperatura di Fig. 54 a pag.160.
Gli esperimenti sono stati compiuti in una soluzione gelatinosa, al 2,5% in peso, come materiale che simuli quello biologico. La gelatina aggiunta all'acqua non ne cambia significativamente le proprietà termofisiche. Inoltre la struttura compatta della gelatina previene effetti per convezione, assicurando così che il calore si trasmetta solo per conduzione, e producendo un modello più aderente alla realtà biologica dei tessuti.
Le Fig. 53b,c,d mostrano il congelamento rispettivamente dopo uno, quattro e dieci minuti. Si vede chiaramente dalla figura b che un criobisturi, esattamente quello posto più in basso, ha un tasso di raffreddamento più basso rispetto agli altri: questo tipo di deviazioni sono tipiche nei criobisturi. Nel caso particolare questo scadimento di prestazioni non ha effetti nel test di fattibilità, ed è indicato anche nel seguito. E' interessante notare come le zone congelate risultino perfettamente cilindriche, con asse ognuna il proprio criobisturi, fino a quando le zone hanno cominciato ad unirsi. La figura c mostra la regione congelata in uno stadio successivo, dopo che le quattro zone si sono unite in una singola regione producendo una forma irregolare. La figura d mostra la regione in uno stadio avanzato, che si avvicina molto ad un cilindro regolare. Le misure effettuate a questo livello indicano una regione di congelamento dal diametro medio di 70 mm con una variazione del 5% (3,5 mm). Questa misura prova che le differenze di comportamento tra i vari criobisturi, viste nei primi momenti del congelamento, non minano assolutamente la riuscita della procedure nei dei successivi stadi di una operazione.
Il crioscaldatore è stato attivato prima dell'inizio del congelamento, fissando la temperatura a 37°C. Gli effetti di questo riscaldamento possono essere visti chiaramente nel riquadro della figura d, dove si nota un ben definita zona non congelata, dello spessore medio 0,8 mm, attorno al crioscaldatore. In una applicazione chirurgica questa zona sarebbe stata protetta dall'azione distruttiva della formazione di cristalli. Si ricorda che gli effetti nocivi a lungo termine del criobisturi non sono associati solo al congelamento, ma anche emorragie dovute a improvvise rotture del sistema vascolare e ai problemi dei processi di guarigione post operatori, ma sono al di fuori degli scopi di questo studio.
Formulazione matematica
Per analizzare il calore trasferito nel modello con la gelatina, e per fare uno studio iniziale dei parametri che influiscono il crioscaldatore nelle applicazioni chirurgiche, è stato scritto un codice per una simulazione numerica. Per input della simulazione si è presa la legge che regola la temperatura dei criobisturi e del crioscaldatore, le temperature iniziali della gelatina, o del tessuto biologico, le dimensioni geometriche e le proprietà fisiche della gelatina, o del tessuto biologico. Il risultato di questo programma[23] è la propagazione del fronte di congelamento e la distribuzione di temperatura come funzione del tempo.
Per modellizzare il calore trasferito nei tessuti, tenendo conto della perfusione sanguigna, si è fatto ricorso all'equazione di Pennes:
dove il pedice b si riferisce, come usuale, al sangue e il pedice met al metabolismo.
Lo schema utilizzato per risolvere l'equazione alle differenze finite è il seguente:
dove i pedici  e
e 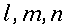 indicano le coordinate dello spazio, mentre p è l'indice del tempo.
indicano le coordinate dello spazio, mentre p è l'indice del tempo. 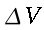 è un elemento di volume,
è un elemento di volume, 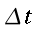 un intervallo di tempo e R è la resistenza termica tra il punto di coordinate
un intervallo di tempo e R è la resistenza termica tra il punto di coordinate 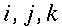 e il vicino
e il vicino 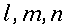 . Questo schema risulta stabile, e il suo approccio può essere utilizzato anche in altri ambiti della criochirurgia.
. Questo schema risulta stabile, e il suo approccio può essere utilizzato anche in altri ambiti della criochirurgia.
La Tabella 4 elenca i valori tipici delle proprietà termofisiche della gelatina e dei tessuti biologici, usati in questo studio. Sia nel caso della gelatina che nelle simulazioni al computer, il crioscaldatore è stato ad una temperatura approssimativamente costante, uguale alla temperatura iniziale della gelatina o del tessuto. Nell'esperimento della gelatina, la legge seguita dai criobisturi può essere rappresentata da una diminuzione lineare a partire dalla temperatura iniziale del mezzo, fino a scendere a -145°C in 30 s. Dopo questo breve intervallo di tempo, la temperatura del criobisturi si è mantenuta costante per il resto dell'esperimento.
| Proprietà | Acqua | Sangue |
|---|---|---|
Conduttività termica, 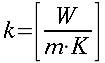 | 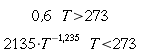 | 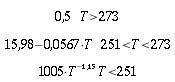 |
Calore specifico per unità di volume 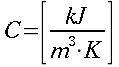 | 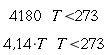 | 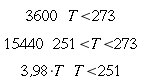 |
Calore latente 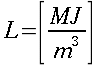 | 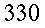 | 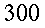 |
Riscaldamento dovuto allaperfusione sanguigna 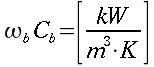 | 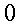 | 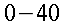 |
Tabella 4 Proprietà termofisiche dell'acqua e dei tessuti congelati usati in questa analisi. Le temperature sono in K.
Analisi dei risultati sperimentali
La Fig. 54 mostra le distribuzioni di temperatura calcolate lungo il raggio della zona congelata, partendo dal crioscaldatore, le sezioni sono quelle indicate dalla Fig. 53 a pag.154. Le linee tratteggiate rappresentano il crioscaldatore e il criobisturi, le linee continue rappresentano la distribuzione di temperatura, mentre i numeri accanto alle linee continue sono i secondi passati dall'inizio dell'esperimento.
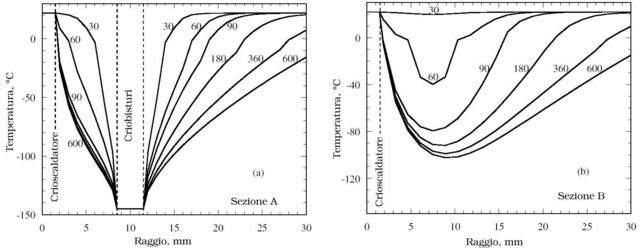
Fig. 54 Distribuzione di temperatura ottenuta con la simulazione matematica, dell'esperimento con la gelatina. Prendendo come riferimento il crioscaldatore e misurando radialmente partendo da esso: a) sezione, indicata in Fig. 53d a pag.154, contenente un criobisturi. b) sezione orientata a 45° rispetto alla precedente, sempre indicata in Fig. 53d.
Si può vedere dalla Fig. 54a che nella regione fra il crioscaldatore e il criobisturi raggiunge uno stato quasi stazionario molto rapidamente. Per esempio, la temperatura dopo 360 secondi e 600 secondi risulta la stessa. Per giunta anche la distribuzione dopo 180 s e 600 s si differenziano di valori del tutto insignificanti. Mentre dall'altro lato rispetto al criobisturi non si riesce a raggiungere alcuno stato stazionario. Si può dimostrare matematicamente che, se il potere calorifico del crioscaldatore è minore della somma dei poteri calorifici di raffreddamento di tutti i criobisturi, non c'è una soluzione stazionaria del problema. Comunque in criochirurgia c'è da considerare che l'effetto termico della perfusione sanguigna limita la zona di congelamento anche in assenza di crioscaldatore.
Osservando la Fig. 54b si nota come anche in questo caso la temperatura vicina al crioscaldatore raggiunge velocemente uno stato stazionario, però la distribuzione di temperatura risulta più moderata rispetto alla sezione precedente. Per esempio, la temperatura minima nella sezione B dopo 600 secondi è circa 40°C più alta che nella sezione A. Comparando i profili delle temperatura, appare chiaro che la temperatura minima nella sezione B non diminuisce velocemente, e così si creerà una differenza di temperatura che perdurerà per tutto l'intervento. Va aggiunto che inizialmente la distanza tra il crioscaldatore e il minimo della distribuzione di temperatura risulta più piccola della distanza fra il crioscaldatore e il criobisturi; con il passare del tempo la distanze tendono a diventare uguali. Guardando con attenzione la distribuzione di temperatura della sezione B dopo 60 s, notiamo che possiede una forma molto irregolare. Questa irregolarità è data dal rapido cambiamento delle proprietà termofisiche della gelatina durante il cambio di fase, che rende il gradiente di temperatura estremamente scosceso.
Per la soluzione gelatinosa, la transizione fra gel e solido avviene a 0°C. Per i tessuti biologici si ha il cambiamento di fase tra 0°C e -22°C, se si assume il comportamento termico simile a quello di una soluzione di NaCl. Con questi dati si potrebbe sostenere che la gelatina si differenzi eccessivamente dal tessuto umano dal rendere il test di fattibilità non valido; per fortuna ciò non è vero, poiché il campo di temperatura in cui si ha il passaggio da una fase all'altra è al di sopra del campo di temperatura che si viene a creare e quindi il trasferimento di calore non ne viene influenzato.
Si potrebbe obbiettare che il sangue produce un maggiore riscaldamento, rendendo nullo l'esperimento con il gel. Per confutare questo dubbio è stata fatta una nuova simulazione utilizzando come parametri le proprietà dei tessuti biologici al posto della gelatina, e il massimo riscaldamento generabile dalla perfusione sanguigna (confronta Tabella 3). I risultati di questa simulazione sono mostrati in Fig. 55.
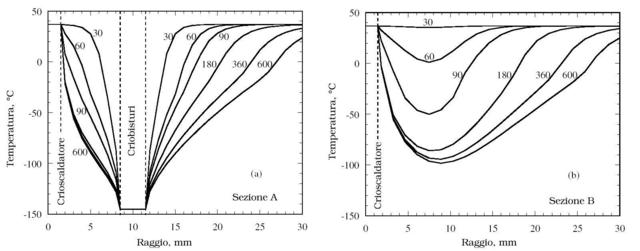
Fig. 55 Simulazione del congelamento in un tessuto biologico. Le sezioni a sinistra (a) e a destra (b) sono quelle indicate in Fig. 53 a pag.154.
Si vede chiaramente che i risultati ottenuti con la gelatina sono validi anche per i tessuti biologici, per di più, in questi ultimi, la temperatura minima della sezione B è più alta di solo 5°C rispetto alla sezione A, mentre nel caso della gelatina vi era una disparità di 40°C.
Discussione dei risultati
L'utilizzo di un test di fattibilità in un piano ha portato diversi vantaggi. L'esperimento di Fig. 52 ha permesso l'osservazione dal vero sia delle regioni ghiacciate che delle regioni limitrofe scongelate, tali osservazioni sono possibili solo con gel ma non in condizioni cliniche. Oltretutto, in condizioni cliniche, il sottile strato cilindrico non congelato attorno al crioscaldatore non può essere osservato con le tecniche di elaborazione delle immagini odierne, poiché le regioni congelate bloccano i segnali usati da queste tecniche. Anche se venisse sviluppato un trasduttore adatto a lavorare con queste temperature, la risoluzione delle immagini per strati inferiori al millimetro rimangono la barriera più grande.
Questo modello però può essere preso ad esempio solo per alcuni tipi di operazione, come la chirurgia prostatica; per altri tipi di operazione non riesce a descrivere tutte le condizioni reali per i seguenti aspetti:
- In assenza di fonti di calore, come può essere la perfusione sanguigna, il processo sperimentale non raggiunge mai uno stato stazionario.
- I moderni criobisturi possono essere più piccoli di 3 mm di diametro.
- Il riscaldatore uretrale ha un diametro superiore ai 3 mm.
- Il modello con la gelatina è fondamentalmente bidimensionale, mentre i processi di criochirurgia sono tridimensionali.
Il test con la gelatina è stato fatto solo per vedere la fattibilità del progetto, mentre per studiare i risultati dal punti di vista clinico è stata elaborata la simulazione matematica.
La Fig. 56 presenta i risultati di uno studio sui parametri del crioscaldatore, attraverso l'analisi di quattro casi che simulano un intervento alla prostata. Generalmente la prostata, quando deve essere operata, varia dai 25 ai 50 mm; per gli scopi di questo studio viene preso come diametro della prostata 30 mm circa e una lunghezza media di 35 mm. Queste dimensioni sono scelte arbitrariamente, ma in un campo molto ragionevole, per dimostrare gli effetti del criobisturi.
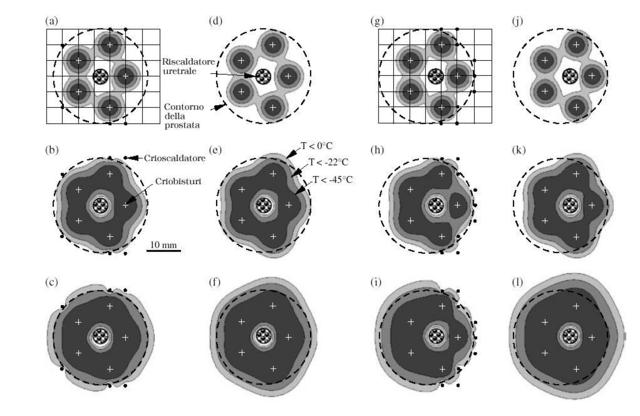
Fig. 56 Studio parametrico del crioscaldatore. Sono presentati quattro casi: a-c, d-f, g-i, j-l. Quattro differenti temperature sono individuate dai quattro colori: il bianco rappresenta zone non congelate, il grigio chiaro temperature tra 0 e -22°C, il grigio da -22 a -45°C, il grigio scuro al di sotto dei -45°C. I segni + rappresentano i criobisturi, mentre i cerchietti neri i crioscaldatori.
Nel caso 1 il diametro del riscaldatore uretrale è 5 mm, ed è posto al centro della sezione. Il diametro dei criobisturi è di 1 mm, cominciano a raffreddare dalla temperatura corporea iniziale, 37°C, portandosi dopo 30 s a -145°C. Il diametro del crioscaldatore è di 1 mm, e mantiene una temperatura di 37°C. Per il posizionamento dei crioscaldatori si può usare la medesima tecnica dei criobisturi, cioè utilizzare una griglia con intervalli ogni 5 mm. Il caso 1 è mostrato schematicamente in Fig. 56a, insieme alla griglia e il contorno di 30 mm di diametro della prostata. I risultati del caso 1 dopo 70, 130 e 230 s sono mostrati rispettivamente dalle Fig. 56a,b,c; tre livelli di grigio sono stati utilizzati per mostrare le diverse temperature: il grigio più scuro per indicare le temperature sotto i -45°C, il grigio normale per le temperature fra -45°C e -22°C, il grigio tenue per le temperature tra -22°C e 0°C. Tutte le altre zone sono da considerarsi sopra lo 0°C. Ricordiamo che il danno biologico maggiore si ha proprio nella fase di transizione tra 0°C e -22°C, poiché vi è la formazione di cristalli in seno alle cellule, mentre la temperatura letale per la distruzione delle cellule è al di sotto dei -45°C. Nella Fig. 56c il processo di congelamento può essere controllato creando il contorno isotermo desiderato, in questo modo è possibile modificare la distribuzione della temperatura nella prostata a seconda delle esigenze geometriche dell'organo stesso.
Il caso 2 è simile al caso 1 a parte la mancanza di crioscaldatori. Le Fig. 56d,e,f mostrano rispettivamente le temperature a 70, 130 e 230 s dall'inizio del congelamento. Il modo più semplice di comparare i due casi è di confrontare la distribuzione delle tre fasce di temperatura. Nel caso 1 per congelare il 90% dell'organo portandolo al di sotto di -22°C, si è dovuto portare, esternamente alla prostata, un'area pari al 24% dell'organo sotto i 0°C e pari al 1% sotto i -22°C. Nel caso 2, invece, per ottenere sempre il 90% della prostata congelata, si porta una zona esterna pari al 40% dell'organo sotto 0°C mentre il 12% sotto i -22°C. Risulta chiaro quindi l'importanza di controllare attraverso i crioscaldatori l'andamento delle temperature. Inoltre, come si vede dalla Fig. 56f la temperatura viene raggiunta dopo 230 s e ogni raffreddamento aggiuntivo sarebbe letale per gli organi e i tessuti circostanti.
Nei casi 1 e 2 le posizioni della griglia, dei criobisturi e crioscaldatori, sono state scelte sia per minimizzare l'area esterna alla prostata raffreddata sotto 0°C, che per massimizzare l'area interna alla prostata raffreddata sotto i -22°C. Poiché i campi di temperatura sono continui, queste due condizioni sono in contraddizione. Gli studi attuali provano un approccio a tentativi di differenti configurazioni. Ottimizzare questo problema è molto difficile perché i due obbiettivi sono totalmente conflittuali, l'uso di crioscaldatori argina il problema aggiungendo un mezzo per controllare la regione congelata. Per riuscire ad ottimizzare la soluzione la ricerca sta lavorando da anni su software in grado di calcolare caso per caso la migliore disposizione da adottare, si vedano ad esempio i lavori del prof. Stahovich dal 2000 [26] e del prof. Bal dal 2002 [27]11.
Il caso 3 è simile, in linea di principio, al caso 1, eccetto che per l'uretra è spostata si 3 mm sulla destra rispetto al centro. Generalmente, infatti, l'uretra risulta sempre decentrata, anche maggiormente di 3 mm. In questo caso la griglia di posizionamento deve essere spostata per ottenere il risultato migliore. Come si vede dalle Fig. 56g,h,i sono stati applicati nove crioscaldatori, rispetto ai sei del caso 1, e ognuna di esse si riferisce rispettivamente a 70, 130 e 290 s dall'inizio del trattamento.
Il caso 4 risulta identico al caso 3 ad eccezione della totale mancanza di crioscaldatori.
Anche in questi ultimi due casi i crioscaldatori riescono a contenere e modellare la zona di congelamento. L'unico potenziale inconveniente di questo nuovo approccio è l'elevato numero di crioscaldatori da utilizzare nel caso di geometrie complesse, però i vantaggi che ne derivano in termini di miglioramento dell'operazione chirurgica sono evidenti.
Come si vede dalla Fig. 56i i crioscaldatori possono essere messi come una vera e propria barriera termica. In questa situazione il campo di temperature a destra dell'uretra ha raggiunto una condizione stabile, mentre il campo a sinistra dell'uretra continua ad evolvere. Posizionare una barriera di questo tipo tra la prostata e l'intestino, rende l'operazione notevolmente più sicura. Una barriera così fatta, inoltre, non dovrebbe generare nessun tipo di artefatto in una acquisizione di immagini ad ultrasuoni, generalmente utilizzata in operazioni alla prostata. Se si considera anche la possibilità che un criobisturi possa avere delle avarie o alterazioni, come si è visto con l'esperimento con la gelatina, l'aggiunta di una barriera termica va in favore solo della sicurezza.
I casi 1-4 sono esempi di procedure su aree molto piccole. Le aree piccole sono più difficili da controllare, a causa del piccolo numero di punti sulla griglia utilizzabili per posizionare criobisturi e crioscaldatori. Inoltre, l'operazione chirurgica si svolge in tempi più brevi, aumentando il rischi di commettere errori irreparabili.
Sia l'esperimento compiuto sulla gelatina che il modello computerizzato mostrati sono di tipo bidimensionale, ma ciò non vuol dire che non abbiano validità nelle operazioni reali. Nel caso dell'operazione alla prostata, per esempio, il modello matematico da una predizione dello sviluppo, sezione per sezione, delle temperature nei tessuti interessati.
Oggi ancora mancano schemi per un software di ottimizzazione delle posizioni dei criobisturi e crioscaldatori in 3D, sia perché, da un lato, non è pensabile poter andare per tentativi, poiché il costo della simulazione risulta troppo alto ed è molto più difficile visualizzare gli effetti di un cambiamento di configurazione, dall'altro per l'elevata potenza di calcolo per ogni simulazione. Gli sforzi della ricerca puntano proprio nel mettere a disposizione dei chirurghi degli strumenti che ottimizzino il posizionamento sia bidimensionalmente che tridimensionalmente.
Distribuzione della temperatura sulla testa durante il raffreddamento dello scalpo
Introduzione
Questo paragrafo introduce un breve e nuovo studio in un settore dell'ingegneria clinica che si distacca dagli ambiti abituali a cui generalmente sembra relegata.
Generalmente per combattere gli effetti dannosi di alcuni farmaci, in medicina, si tende a contrastarli con altri farmaci o a diminuire la dose dei primi. La chemioterapia è una delle cure più pesanti dal punto di vista dell'organismo, poiché tende a distruggere indiscriminatamente sia le cellule malate che quelle sane, cellule che in gran parte sono essenziali per il sistema immunitario. Uno degli effetti secondari per una persona sottoposta a chemioterapia è la perdita dei capelli, benché questa perdita sia del tutto ininfluente dall'effetto positivo o negativo della cura e non mini la salute del paziente, riduce la qualità della vita della persona sottoposta alla cura.
Una persona adulta che subisce un trattamento chemioterapico tende ad indebolirsi notevolmente, ma la perdita dei capelli, molte volte anche in maniera permanente, rende il malato debole e fragile anche dal punto di vista psicologico; sia perché viene colpita l'estetica della persona, a cui la società moderna da un forte peso, sia perché il malato viene riconosciuto da chiunque lo veda come "malato di cancro", rendendo difficile l'evasione dalla situazione dura che si trova ad affrontare.
Per questi motivi da alcuni anni si utilizza durante le sedute di chemioterapia un casco contenente un gel freddo, che raffreddi il cranio(v. Fig. 57). Raffreddando il cranio, infatti, a causa del restringimento dei vasi sanguigni, viene diminuita la quantità di sangue che affluisce sullo scalpo, e quindi anche la quantità di farmaci che arrivano alla cute. Inoltre, riducendo la temperatura viene ridotta la reattività degli enzimi: in questo modo si riducono gli effetti dei farmaci citotossici, diminuendo sia i danni alle cellule che il numero delle cellule uccise.
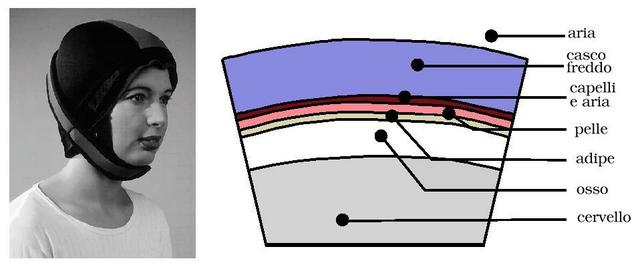
Fig. 57 A sinistra foto del casco applicato su una paziente. A destra i vari strati considerati nello studio.
Sfortunatamente questa tecnica non produce sempre gli stessi risultati, certe volte si riesce a preservare tutti i capelli, altre solo alcune zone, ed anche a non ottenere alcun beneficio.
Le ragioni di queste differenze non sono ancora chiare, per questo motivo è cominciato uno studio all'università di Eindhoven, in Olanda, per determinare la distribuzione di temperatura sulla testa durante il raffreddamento, e capire da quali parametri dipenda.
Metodologia
Per schematizzare la testa con indosso il casco si è scelto di adottare un modello lineare, ipotizzando la testa come una sfera perfetta, composta da più strati concentrici, come si vede in Fig. 57 a destra.
L'equazione che governa il trasferimento di calore è sempre l'equazione di Pennes, che viene risolta imponendo la temperatura del sangue costante e pari a 37°C, mentre la temperatura del casco risulta all'inizio pari a -30°C.
Lo studio da parte del prof. Van Lenthe dell'università di Eindhoven ha esaminato diversi aspetti, ma i principali fattori che modificano la distribuzione di temperatura, da un punto strettamente analitico sono lo spessore della pelle e lo spessore dell'intercapedine d'aria tra il casco e la cute. Altri parametri come la perfusione sanguigna e il metabolismo sembrano non addurre particolari cambiamenti.
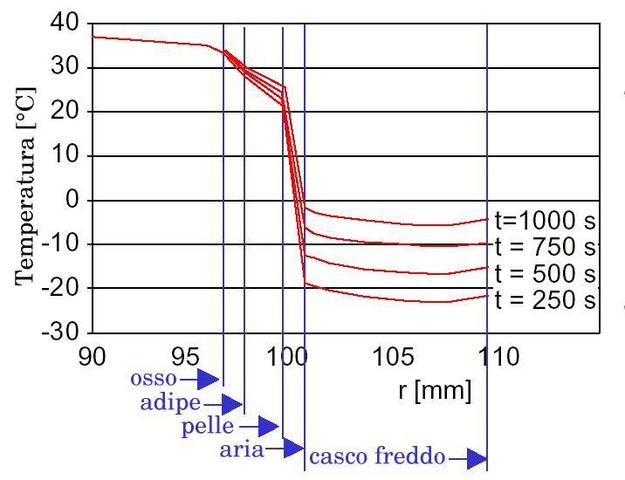
Fig. 59 Distribuzione di temperatura sulla testa in una configurazione standard in diversi momenti.
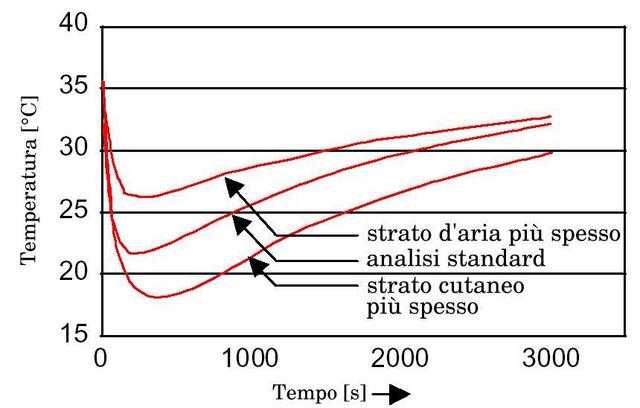
Fig. 60 Temperature dello scalpo in tre diverse configurazioni: normale, spessore della cute doppio, spessore dell'aria doppio.
Si vede dalla Fig. 60 che la temperatura minima viene raggiunta dopo 220 secondi, cioè 3 minuti, arrivando a 22,5°C. L'efficacia del metodo risulta compromessa nel caso che lo spessore dell'aria tra cute e casco superi 1 cm, questo significa che i caschi debbono essere progettati di tipo morbido e aderente, regolabili e con un sistema che tenda il più possibile a evitare la formazione di zone dove il casco non tocchi direttamente lo scalpo.
Le simulazioni matematiche sono state confrontate con delle misurazioni sulla testa di soggetti tramite delle termocoppie; le temperature di entrambe hanno dato gli stessi risultati.
Discussione dei risultati
Dagli studi si evincono delle considerazioni che erano prevedibili a livello intuitivo, per capire bene il processo che influisce sulla caduta dei capelli c'è bisogno di uno studio delle differenti regioni della testa. Attraverso un modello tridimensionale si dovrebbe riuscire a descrivere il calore che fluisce verso la radice dei capelli, inoltre bisogna raccogliere ulteriori dati clinici sulla caduta dei capelli per stabilire la metodologia migliore per progettare un casco più adatto.
Cambiamenti delle proprietà ottiche durante la laser fotocoagulazione interstiziale
Introduzione
L'uso di fibre ottiche, come mezzo per curare zone poste in profondità nell'organismo, si è dimostrato valido fin dai primi anni ottanta. Grazie ad essi è possibile trasportare il calore in zone difficilmente operabili, e procedere alla coagulazione della regione tumorale. Per una cura efficace del tumore è necessario che la coagulazione raggiunga un volume pari a quello del tumore stesso, sfortunatamente uno dei limiti principali della laser fotocoagulazione interstiziale è proprio nelle dimensioni delle lesioni prodotte, che generalmente variano da 1 a 3 cm di diametro per singola fibra. L'aumento della potenza emessa dal laser non risolve del tutto il problema, poiché, è vero che la zona coagulata aumenta le sue dimensioni[30], ma il picco di temperatura tende a raggiungere e superare il punto di vaporizzazione, ottenendo la formazione di bolle e la carbonizzazione sia del tessuto che della punta della fibra ottica.[52]
Sia la carbonizzazione che la formazione di bolle sono effetti indesiderati, da un lato perché il tessuto carbonizzato rimarrebbe nell'organismo, dall'altro perché la formazione di bolle può causare l'aumento della pressione interstiziale e all'occorrenza formare delle embolie potenzialmente letali per il paziente.[11,52]
Per evitare questi effetti indesiderati basta che la temperatura non superi il punto di vaporizzazione; ma la massima temperatura dipende dalle proprietà ottiche, termiche, dalla portata sanguigna, geometria dell'irradiazione e dalla potenza utilizzata dal laser. Risulta chiaro come oggi sia ancora difficile predire la potenza massima da usare col laser per evitare la carbonizzazione dei tessuti.
Un notevole numero di studi sono stati compiuti per schematizzare e capire la risposta dei tessuti durante la laser fotocoagulazione[45, 48, 44, 23]. Lo schema convenzionale adottato è il seguente: calcolo della distribuzione della luce, calcolo della distribuzione di temperatura, calcolo dell'estensione del danno ai tessuti. Chiaramente ogni passaggio richiede informazione da quello precedente e da misure sperimentali o elaborazioni matematiche delle proprietà del tessuto.
La soluzione più semplice elaborata consiste nel considerare costanti le proprietà del tessuto al variare della temperatura, ottenendo un gruppo di soluzioni lineari [1, 2, 19, 31]. Le proprietà del tessuto, in realtà, variano anche in maniera considerevole al variare della temperatura, e quindi sono stati sviluppati modelli non lineari che tengono conto delle variazioni delle proprietà ottiche [31], della perfusione sanguigna [39,40], o di entrambe [47, 34, 22, 19, 16, 10, 2b]. Comunque, le prove sperimentali, per dimostrare l'accuratezza di tali modelli, sono state scarse, anche perché è difficile riprodurre i processi dinamici in condizioni controllate di laboratorio.
Tra i vari schemi elaborati uno dei più utilizzati tra quelli di tipo lineare è di considerare le proprietà del tessuto pari a quelle a temperatura ambiente fino a 60°C, superata questa temperatura, che viene postulata pari a quella critica, le proprietà del tessuto vengono considerate come quelle di un tessuto coagulato [47, 34, 2b]. In questo modo la soluzione risulta lineare a tratti.
Per i modelli di tipo non lineare si utilizza generalmente il modello termico di Arrhenius12 per stabilire il danno prodotto dal calore e i cambiamenti delle proprietà ottiche [10, 31, 20, 2b].
Nelle pagine successive sarà mostrato un metodo non lineare e la sua validazione sperimentale per applicazioni di chirurgia epatica.
Materiali e metodi
Modello matematico
Il modello optotermico di una laser fotocoagulazione interstiziale consiste nel calcolo della distribuzione della luce, della temperatura e della estensione del danno termico. Le seguenti sezioni descrivono ogni le implementazioni matematiche di ogni stadio.
Distribuzione della luce nei tessuti
La luce emessa da una fibra interstiziale è stata modellata come un sorgente puntiforme con radianza isotropa, situata al centro del sistema coordinate sferiche. La propagazione del fotone dalla sorgente è descritta dalla teoria di trasporto della radiazione [38, 51, 26], ma la soluzione di tale equazioni è stata trovata solo per alcuni casi specifici. Comunque se nel processo l'assorbimento è generale e diffuso si può utilizzare un'approssimazione, data dalla seguente equazione:
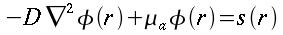 | (66) |
Con
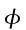 = emissione integrale
= emissione integrale 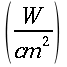
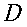 = coefficiente di diffusione
= coefficiente di diffusione 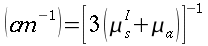
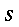 = sorgente termica
= sorgente termica 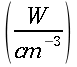
avendo indicato con 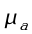 il coefficiente di diffusione nei tessuti e con
il coefficiente di diffusione nei tessuti e con 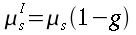 il coefficiente di riduzione della diffusione, mentre
il coefficiente di riduzione della diffusione, mentre 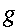 è il fattore di anisotropia[50]. La soluzione della 66 è:
è il fattore di anisotropia[50]. La soluzione della 66 è:
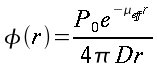 | (67) |
Avendo indicato con 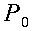 la potenza emessa dalla fibra ottica, e con
la potenza emessa dalla fibra ottica, e con 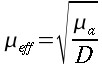 l'attenuazione effettiva.
l'attenuazione effettiva.
La densità della potenza assorbita è:
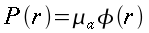 | (68) |
Calcolo dell'innalzamento della temperatura
L'assorbimento della luce causa un locale innalzamento della temperatura. Per il trasferimento del calore ai tessuti si fa riferimento all'equazione di Pennes:
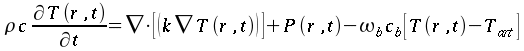 | (69) |
Dove oltre ai termini usuali troviamo anche P che rappresenta la potenza depositata  .
.
Poiché il problema ha una simmetria sferica, come la distribuzione dell'energia dovuta al laser, può essere risolto nel dominio dello spazio grazie alla sola variabile r, distanza radiale dalla sorgente d'energia. Il campo studiato parte dalla distanza  , cioè dal bordo della fibra ottica, fino alla posizione
, cioè dal bordo della fibra ottica, fino alla posizione 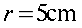 , considerata sufficientemente lontana da non subire più gli effetti del laser. Le condizioni al bordo sono due, sull'estremo della fibra ottica:
, considerata sufficientemente lontana da non subire più gli effetti del laser. Le condizioni al bordo sono due, sull'estremo della fibra ottica:
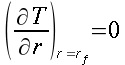
poiché la simmetria sferica impone che non ci sia un flusso di energia nella direzione della fibra.
La seconda condizione imposta invece esprime che a sufficienza distanza dalla fibra ottica non si risentano i suoi effetti, matematicamente:
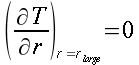
Calcolo del danno termico
L'aumento di temperatura provoca un danno irreversibile, in accordo con la legge di Arrhenius il grado del danno al tessuto può essere quantificato con l'indice  :
:
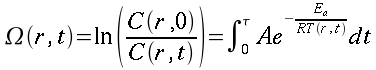 | (70) |
Dove
 = indice del danno (adimensionale)
= indice del danno (adimensionale) = concentrazione dei tessuti danneggiati
= concentrazione dei tessuti danneggiati = Energia d'attivazione
= Energia d'attivazione 
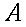 = fattore di frequenza
= fattore di frequenza 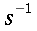
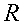 = costante universale dei gas
= costante universale dei gas 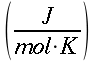
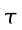 = tempo totale di riscaldamento
= tempo totale di riscaldamentoL'energia di attivazione 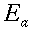 e il fattore di frequenza sono derivati dalle variabili termodinamiche
e il fattore di frequenza sono derivati dalle variabili termodinamiche 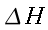 e
e  , rispettivamente calore di attivazione e funzione di Gibbs [18]; esse sono legate ai processi di denaturazione delle proteine e di altri costituenti cellulari. L'equazione 70 indica che l'indice del danno,
, rispettivamente calore di attivazione e funzione di Gibbs [18]; esse sono legate ai processi di denaturazione delle proteine e di altri costituenti cellulari. L'equazione 70 indica che l'indice del danno, 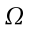 , è il logaritmo del rapporto tra la concentrazione di tessuti non danneggiati prima che cominci l'operazione e la percentuale al tempo
, è il logaritmo del rapporto tra la concentrazione di tessuti non danneggiati prima che cominci l'operazione e la percentuale al tempo 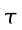 . I valori di
. I valori di 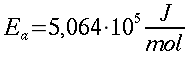 e
e 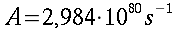 sono presi dagli studi di Borrelli del 1990 [3] compiuti sui reni dei cuccioli di criceto.
sono presi dagli studi di Borrelli del 1990 [3] compiuti sui reni dei cuccioli di criceto.
Effetti non lineari nella dinamica delle proprietà ottiche
E' stato già detto che la coagulazione modifica le proprietà del tessuto, come l'assorbimento e il coefficiente di diffusione; questo fenomeno è ben visibile sui tessuti, perché si manifesta con la formazione di una sfera coagulata con attorno i tessuti non coagulati. Per schematizzare questo fenomeno e risolverlo analiticamente si è pensato di dividere in due sfere concentriche lo spazio attorno alla fibra ottica (v. Fig. 61). In questa maniera la sfera più interna rappresenta la zona coagulata, con le proprietà 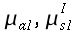 , mentre quella più esterna, per
, mentre quella più esterna, per 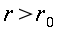 , possiede le proprietà
, possiede le proprietà 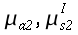 . Il raggio della regione più esterna si può estendere fino all'infinito.
. Il raggio della regione più esterna si può estendere fino all'infinito.
Fig. 61 Diagramma dei due strati per approssimare la soluzione analitica. Il limite fra le due regioni è r.
Questo approccio richiede uno sforzo computazionale minore rispetto all'uso dei metodi numerici che deve discretizzare e risolvere le equazioni nell'intero dominio. Inoltre è stato dimostrato [46] che entrambe le vie conducono allo stesso risultato. La soluzione analitica e la sua derivazione per gli studi mostrati in queste pagine viene discussa nell'appendice A, a pag.199, alla fine del capitolo.
La soluzione della distribuzione delle proprietà in due strati, è stata ricalcolata in continuo per ogni nuovo valore di 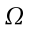 che mostra l'avanzamento della regione coagulata. Inoltre si è posto:
che mostra l'avanzamento della regione coagulata. Inoltre si è posto:
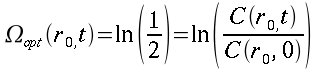
Cioè nella regione per 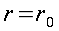 metà delle cellule sono coagulate e metà sono sane.
metà delle cellule sono coagulate e metà sono sane.
Quindi per ogni cambiamento della potenza del laser, 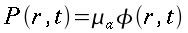 , ricade sulla futura temperatura,
, ricade sulla futura temperatura, 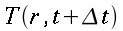 , che influenza
, che influenza 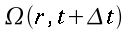 e in ultima analisi
e in ultima analisi 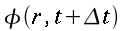 e
e 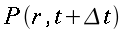 .
.
Calcoli con il metodo alle differenze finite
L'equazione di Pennes è stata risolta utilizzando il metodo alle differenze finite. Con questo metodo le derivate parziali divengono:
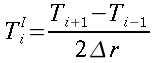
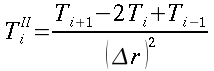
sostituendo nell'equazione della trasmissione del calore, abbiamo:
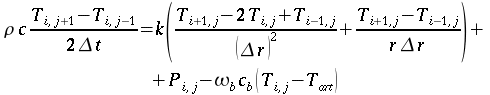 | (71) |
Dove il pedice i rappresenta il nodo della maglia in cui è stato modellato lo spazio, mentre il pedice j rappresenta l'intervallo di tempo.
Il metodo utilizzato calcola la temperatura di un nodo all'istante successivo, utilizzando la temperatura dei nodi vicini l'istante precedente. Al tempo zero viene data una distribuzione di temperatura  per tutti i nodi. La temperatura al tempo
per tutti i nodi. La temperatura al tempo  è calcolata utilizzando la 71:
è calcolata utilizzando la 71:
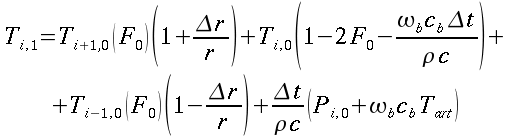 | (72) |
Avendo indicato con 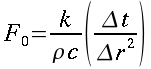 il numero di Fourier. Il calcolo viene ripetuto per tutti gli intervalli di tempo.
il numero di Fourier. Il calcolo viene ripetuto per tutti gli intervalli di tempo.
Applicazione del metodo alle differenze finite al modello non lineare
Nel caso in studio, la presenza di  che varia il suo valore con l'estensione del danno, richiede l'applicazione del metodo alle differenze finite per risolvere l'equazione non lineare della trasmissione del calore nei tessuti. L'approccio scelto è mostrato in Fig. 62: inizialmente si prende il valore della temperatura nel nodo nel precedente intervallo di tempo, questo valore viene utilizzato per calcolare le variazione dell'assorbimento della luce come mostrato a pag. 188. La temperatura viene ricalcolata nelle nuove condizione e confrontata con la precedente, se la differenza tra le due è meno dello 0,1%, la nuova temperatura viene salvata all'interno del programma e si procede al passo successivo, altrimenti la nuova temperatura viene utilizzata per calcolare le modifiche delle proprietà del tessuto e calcolare, con queste ultime, un'altra temperatura, ripetendo questo ciclo finché non si rientra nella tolleranza.
che varia il suo valore con l'estensione del danno, richiede l'applicazione del metodo alle differenze finite per risolvere l'equazione non lineare della trasmissione del calore nei tessuti. L'approccio scelto è mostrato in Fig. 62: inizialmente si prende il valore della temperatura nel nodo nel precedente intervallo di tempo, questo valore viene utilizzato per calcolare le variazione dell'assorbimento della luce come mostrato a pag. 188. La temperatura viene ricalcolata nelle nuove condizione e confrontata con la precedente, se la differenza tra le due è meno dello 0,1%, la nuova temperatura viene salvata all'interno del programma e si procede al passo successivo, altrimenti la nuova temperatura viene utilizzata per calcolare le modifiche delle proprietà del tessuto e calcolare, con queste ultime, un'altra temperatura, ripetendo questo ciclo finché non si rientra nella tolleranza.
Lo schema viene ripetuto per ogni intervallo di tempo.
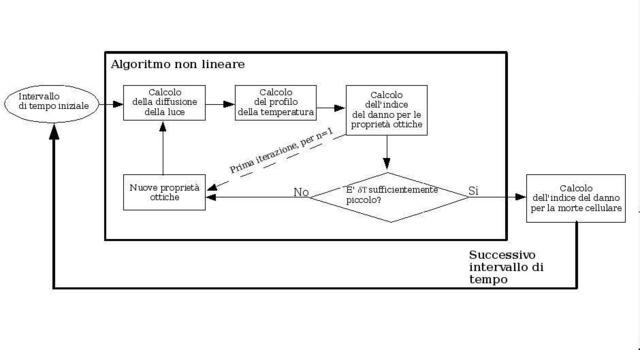
Fig. 62 Diagramma dell'algoritmo che incorpora gli effetti delle variazioni delle proprietà ottiche del tessuto. Con n si indica in numero d'iterazioni fatte per ogni nodo, generalmente più di due.
Validazione sperimentale
Parametri del modello
Il modello teorico è utilizzato per prevedere l'evoluzione della temperatura nei due fantocci, rispettivamente l'albume di un uovo di gallina e il poliacrilammide. L'albume serve per sperimentare le proprietà dinamiche, mentre il poliacrilammide per quelle statiche, poiché le sue caratteristiche sono simili a quelle dell'albume coagulato. Le qualità di entrambi sono elencate in Tabella 5.
I parametri del danno dovuto alla coagulazione sono elencati in Tabella 6, sia per i fantocci che per il fegato. Nel caso dei fantocci la perfusione è stata posta uguale a zero.
| Proprietà | Albume | Poliacrilammide |
|---|---|---|
| Contenuto di acqua(% in massa) | 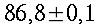 | 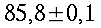 |
Capacità termica c 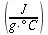 | 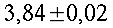 | 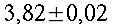 |
Conduttività k 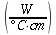 | 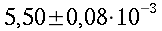 | 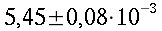 |
Densità 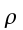 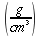 | 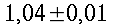 | 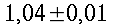 |
Energia di attivazione 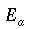 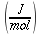 | 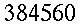 | N/a |
Fattore di frequenza A 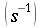 | 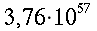 | N/a |
Temperatura critica 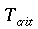  | 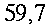 | N/a |
Nativa 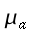 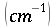 | 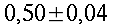 | Stesso valore dell'albume |
Coagulata 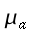 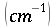 | 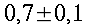 | Stesso valore dell'albume |
Nativa 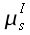 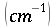 | 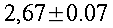 | Stesso valore dell'albume |
Coagulata 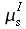  | 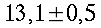 | Stesso valore dell'albume |
Nativa 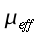 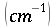 | 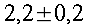 | Stesso valore dell'albume |
Coagulata 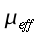 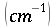 | 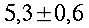 | Stesso valore dell'albume |
Tabella 5 Proprietà biofisiche dell'albume e del poliacrilammide usati nella simulazione. Per temperatura critica s'intende la temperatura che provoca un indice di danno pari a 1 dopo 10 minuti di riscaldamento.
| Parametro fisico | Fantoccio | Fegato |
|---|---|---|
Raggio della fibra ottica  | 750 | 200 |
| Spazio in esame (cm) | 5 | 5 |
| Tempo in esame (min) | 15 | 15 |
Distanza dei nodi dr  | 37 | 33 |
| Tempo di raffreddamento (min) | 5 | 5 |
| Temperatura ambiente (°C) | 24 | 37 |
Tabella 6 Parametri dei fantocci usati nella simulazione e del fegato.
Apparecchiatura sperimentale
Sia l'albume che il poliacrilammide sono stati scaldati in una scatola di plexiglas delle dimensioni mostrate in Fig. 63.
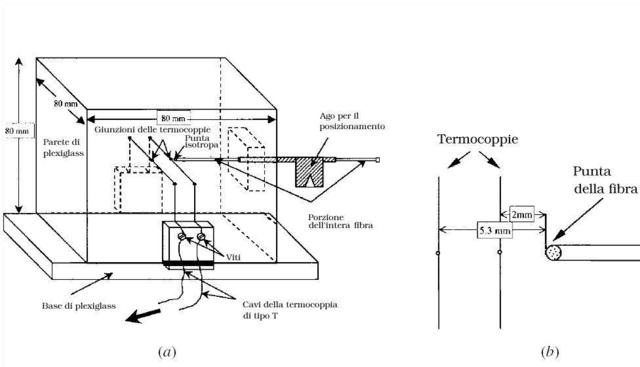
Fig. 63 (a) Schema dell'apparato usato per le misure. (b) Ingrandimento della zona contenente le termocoppie e la fibra.
Per il posizionamento della fibra è stato utilizzato un ago sezionato, in maniera di poterlo levare senza spostare la fibra. Mantenendo la scatola vuota, sono state posizionate due termocoppie di tipo T di 0,076 mm di diametro, la punta della fibra è stata posizionata a 2 mm dalla prima termocoppia. Successivamente la scatola è stata riempita con il materiale per l'esperimento, e si è aspettato che solidificasse, avvolgendo le termocoppie. Dopo aver raffreddato la stanza, il fantoccio è stato riscaldato con un laser utilizzando un Diomed-15 (Diomed Ltd, Cambrige, Inghilterra) a 805 nm per 20 minuti. Per la presenza delle termocoppie, che forniscono una via di fuga per il calore, l'energia fornita dalla fibra è stata considerata il 60% di quella erogata.
Simulazione sul fegato
Questo modello è stato sviluppato per una tipologia clinica consolidata, la laser termoterapia delle metastasi del fegato. Oggigiorno questa cura è stata proposta come cura palliativa delle metastasi del fegato. Generalmente i pazienti che hanno metastasi diffuse per tutto il fegato si ritrovano con poche cure possibili. Il laser, applicato con questo metodo, provvede ad un potente mezzo di cura in tutta sicurezza e con il minimo trauma per il paziente.
Per ottenere il massimo risultato dalla cura, una simulazione può mostrare quale sia il trattamento migliore da seguire prima dell'operazione. Tra i parametri tra cui scegliere, infatti, vi sono: la potenza del laser, la durata del riscaldamento, la posizione della fibra e la sua forma. Inoltre va assolutamente evitata la carbonizzazione della punta della fibra ottica.
Nella simulazione di un'operazione al fegato, chiaramente, la perfusione sanguigna  non viene più considerata uguale a zero, ma pari ad un valore costante per tutta l'operazione.
non viene più considerata uguale a zero, ma pari ad un valore costante per tutta l'operazione.
Risultati
I modelli matematici presentati sono stati confermati sia per le proprietà ottiche dinamiche, albume, sia per quelle statiche, poliacrilammide.
Le temperature misurate dalla termocoppia alla distanza di 5,3mm sono mostrate in Fig. 64a. Le piccole linee verticali indicano il campo di errore, tenendo conto delle tolleranze dei valori delle proprietà termiche, dell'efficienza di accoppiamento della fibra e della misura della posizione. Comunque si vede come i valori, sia teorico che sperimentale siano molto prossimi.
Fig. 64 A sinistra (a): temperature nel fantoccio di poliacrilammide misurate dalla termocoppia a 5,3mm dalla fibra. A destra (b): temperature nel fantoccio di albume.
La Fig. 64b mostra la temperatura misurata nell'albume da entrambe le termocoppie. E' interessante notare come dopo 10 minuti la termocoppia posta a 2mm di distanza dalla fibra ottica mostri un repentino innalzamento di temperatura. Questo fenomeno è dovuto alla coagulazione che raggiunge tale posizione, ed era stato perfettamente considerato dal modello teorico. L'unico scostamento che non era previsto è dal 15° minuto sulla termocoppia posta a 2mm. Il modello matematico prevedeva, infatti, che la curva continuasse a crescere, mentre le misure sperimentali hanno mostrato una diminuzione del gradiente termico. Una spiegazione per tale fenomeno può essere trovata osservando che la punta della fibra ottica a partire dal 15° minuto si trova ad una temperatura, 98°C, prossima a quella di vaporizzazione dell'acqua, questo cambiamento di fase non è stato previsto dal modello matematico, e potrebbe aver innescato delle variazioni nell'assorbimento della luce e nella trasmissione del calore. E' risaputo che la deidratazione dei tessuto modifichi la conduzione dei tessuti stessi. Quindi è molto probabile che la formazione di bolle e vapore abbia provocato un innalzamento della temperatura della punta della fibra, ma la diminuzione dell'assorbimento della luce da parte dei tessuti provochi una diminuzione del gradiente termico ad una certa distanza dalla punta.
La Fig. 65 è una fotografia della lesione termica alla fine dell'operazione, sezionata per il piano r=0. Si riesce a vedere sia la differenza tra la regione coagulata e la regione inalterata, sia una zona di transizione delle dimensioni di 2-3mm. Questa zona di transizione si trova a circa  dal centro.
dal centro.

Fig. 65 Fotografia della lesione formata in seno all'albume dopo 19,5 minuti di trattamento a 3,5W.
Nella simulazione al fegato, la potenza del laser è stata mantenuta al di sotto della punto di vaporizzazione, 97°C. I risultati sono espressi dalle Fig. 66a e b.
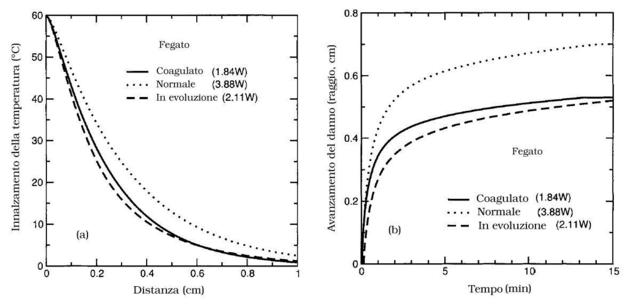
Fig. 66 A sinistra (a): profilo della temperatura dalla simulazione son i parametri del fegato, la temperatura espressa in gradi Celsius e riferita a quella del corpo umano, 37°C, quindi a distanza zero abbiamo 97°C. A destra (b): evoluzione del danno termico misurando a partire dalla fibra ottica.
Discussione dei risultati
L'elaborazione di un modello matematico basato sulla legge di Arrhenius ha mostrato la legge secondo la quale la fibra tende a bruciare, la velocità del cambiamento dei parametri ottici dei tessuti che regolano l'assorbimento del calore ed infine l'andamento del danno termico attorno alla fibra. Tra i vari modelli matematici, questo sembra il più promettente, ma c'è necessità di constatare i risultati in vivo, o perlomeno di una più ampia documentazione clinica dei pazienti trattati con il laser. Il risultato da ricercare a questo livello è di regolare la potenza del laser per ottenere la più grande area coagulata senza provocare la carbonizzazione della punta della fibra ottica.
Appendice A: approssimazione della soluzione nei due strati
Tutta la luce che fluisce all'interno del tessuto può essere descritta come la somma dei contributi dei fotoni per diffusione e per collimazione. Indicando con 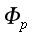 la soluzione particolare nella direzione radiale dell'equazione della diffusione della luce, e
la soluzione particolare nella direzione radiale dell'equazione della diffusione della luce, e 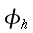 la omogenea associata, si ha:
la omogenea associata, si ha:
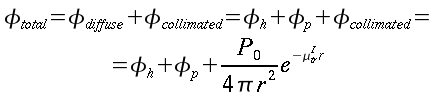
dove 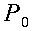 è la potenza della sorgente espressa in Watt e
è la potenza della sorgente espressa in Watt e 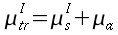 è il coefficiente di attenuazione.
è il coefficiente di attenuazione.
L'equazione della diffusione dei fotoni in forma sferica è:
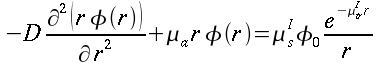
La soluzione omogenea si ottiene ponendo uguale a zero la parte a destra dell'uguale:
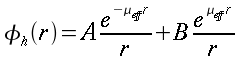
avendo posto 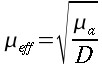 l'attenuazione effettiva. I termini A e B sono coefficienti da valutare.
l'attenuazione effettiva. I termini A e B sono coefficienti da valutare.
Per ottenere la soluzione particolare si può utilizzare la funzione di Green:
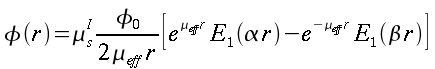
con
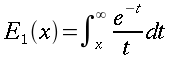 ,
, 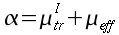 ,
, 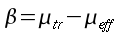
La soluzione particolare è nel nostro caso sempre trascurabile rispetto all'omogenea, perciò sarà di seguito ignorata. Le equazioni dell'omogenea associata scritte per ogni strato sono:
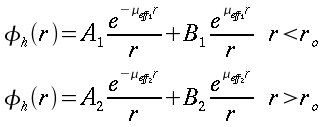
Di questi quattro coefficienti 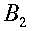 può essere posto immediatamente uguale a zero, perché la diffusione nel secondo mezzo, quello più esterno, tende a zero per r che tende all'infinito. Le condizioni al contorno da imporre sono:
può essere posto immediatamente uguale a zero, perché la diffusione nel secondo mezzo, quello più esterno, tende a zero per r che tende all'infinito. Le condizioni al contorno da imporre sono:
- Stesso flusso di fotoni per
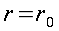
- Velocità di diffusione continua
- Bilancio energetico
In termini matematici:
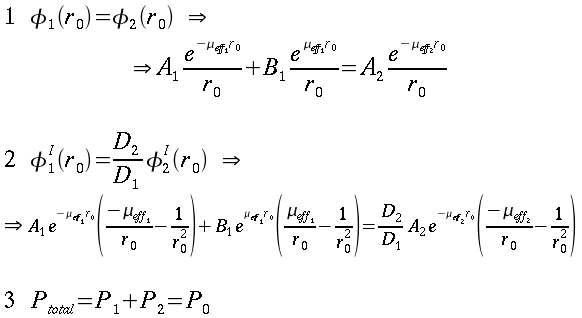
Per la terza equazione:
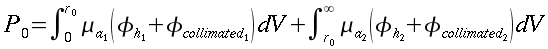
inoltre sapendo che:
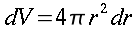
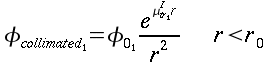
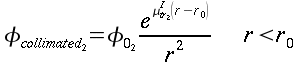
l'equazione di bilancio energetico diventa: 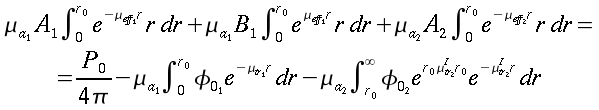
Il sistema può essere risolto semplicemente riducendolo alla seguente forma matriciale:
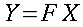 ,
, 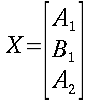 ,
, 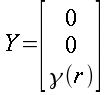
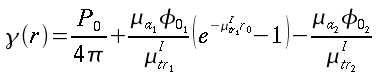
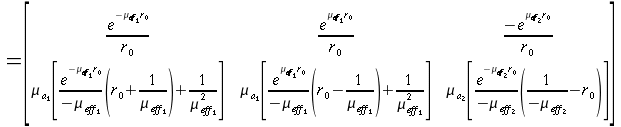
Bibliografia
Capitolo 3.2
- [1] Chan, 1992, Boundary element method for the bioheat transfer equation, ASME J. Heat Transfer, 114, 358-365
- [2] Hsu e Sun et al., 1992, Finite element formulation for two dimensional inverse conduction analysis, ASME J. Heat Transfer, 114, 553-557
- [3] Jones, 1998, A reappraisal of the use of infrared thermal image analysis in medicine, IEEE Transactions on Medical Imaging, 17, 1019-1027
- [4] Keyserlimgk e Ahlgren et al., 2000, Functional infrared imaging of the breast, IEEE Engineering in Medicine and Biology, maggio/giugno, 2000
- [5] Liu e Wang, Method and apparatus for thermal radiotion imaging, U.S. Patent no.6023637
- [6] Loyd-Williams e Handley, 1961, Infrared thermometry in the diagnosis of breast disease, Lancet, 2, 1378-1381
- [7] Qi e Kuruganti et al., 2002, Early detection of breast cancer using thermal texture maps, Electrical and Computer Engineering Departement, Università di Knoxvilee, TN, U.S.A.
Capitolo 3.3
- [1] Seki e Wakabayashi et al., 1994, Ultrasonically guided percutaneous microwave coagulation therapy for small carcinoma, Cancer, 74, 847-825
- [2] Murakami e Yoshimatsu et al., 1995, Treatment of hepatocellular carcinoma: value pf percutaneous microwawe coagulation, American Journal of Rentgenology, 164, 1158-1164
- [3] Ito e Ueno te al., 1989, Interstitial applicator composed of coaxial rings slots for microwavw hyperthermia, 1989 Internation Synposium on Antennas and Propagation, 2, 253-256
- [4] Yee, 1966, Numerical solution of initial boundary value problems involving Maxwell's equations in isotropic media, IEEE Transactions on Antenna and Propagations, AP-14, 302-307
- [5] Zienkiewicz, 1975, The finite element method in engineering Science, Bsifuka, Giappone
- [6] Iwata e Udagawa, 1995, A basic study of coaxial-dipole applicator for microwave interstitial hyperthermia, 12th Annual meeting of the Japanese Society of Hyperthermic Oncology, 230-231
- [7] Taniguchi e Saito et al., 2000, Localized heating and expansion of heating region by using thin coaxial antennas for microwave coagulation therapy, Facoltà d'Ingegneria della Chiba University, Giappone
Capitolo 3.4
- [1] Torvi, 1997, Ph. D. Thesis, Università di Alberta, U.S.A.
- [2] Behnke e Amotz, 1992, Thermo-Man® and thermo-leg: large scale methods for evaluating thermal protecticve perfomance, ASTM STP 1133, Philadeplhia
- [3] Barker, 2001, Modelling of thermal protection outfits for fire explosure, National Textile Center Annual Report, I01-S02
Capitolo 3.5
- [1] Altman e Dittmer, 1971, Respiration and Circulation, Data Handbook.
- [2] Chang Z., Finkelstein J. J., 1994, Development of a high-perfomance multiprobe cryosurgical device, Biomed. Inst. Tech., 28, 383-390.
- [3] Chamy, 1992, Mathematical models of bioheat ransfer, Advance in heat transfer, 19-156.
- [4] Chato, 1985, Selected thermopophysical properties of biological materials, Heat transfer in Biology and Medicine, 413-418.
- [5] Chen e Holmes, 1980, Microvascula contributions in tissue heat transfer, Ann. NY Acad. Sci., 355, 137-146.
- [6] Cohen e Miller e Shumarz, 1995, Urethral warming catheter for use during cryoablation of prostate, Urology, 45, 861-864.
- [7] Cooper e Lee, 1961, Cryostatic congelation: a system for producing a limited controlled region of cooling o freezing of biological tissues, J. Nerve Mental Dis., 133, 259-263.
- [8] Diller, 1992, Modelling of bioheat transfer process at high and low temperature, Advance in Heat Transfer, 157-358.
- [9] Eberhart, 1992, Thermal models f single organs, Heat transfer in biology and medicine, 264-324.
- [10] Gage, 1992, Cryosurgery in treatment of cancer, Surg. Gynecol. Obstet., 174, 171-186.
- [11] Gage e Baust, 1998, Mechanism of tissue injury in cryosurgery, Cryobiology, 37, 171-186.
- [12] Gilbert e Onik e Rubinsky, 1998, MRI guided tissue ablation using cryosurgery, Interventional MR Techiques and Clinical experience.
- [13] Klinger, 1974, Heat transfer in perfused biological tissue: I. General theory, Bull. Math. Biol., 36, 403-418.
- [14] Lee, 1967, Freezin probe for treatment of tissue, especially in neurosurgery, US Patent, 3, 298 371.
- [15] Onik e Cobb e Cohen et al., 1988, US characteristic of frozen prostate, Radiology, 168, 629-631.
- [16] Onik e Gilbert e Hoddick et al., 1985, Sonographic monitoring of hepatic cryosurgery in an experimental animal model, J. Roentgenol., 144, 1043-1047.
- [17] Onik e Cohen e Reyes et al., 1993, Tansrectal ultrasound-guided percutaneous radical cryosurgical abaltion of the prostate, Cancer, 72, 1291-1299.
- [18] Pennes, 1948, Analysys of tissue and arterial blood temperatures in the resting human forearm, J. Appl. Phys., 1, 93-122.
- [19] Rabin e Coleman e Mordohovich et al., 1996, A new cryosurgical device for controlled freezing II: In vivo experiments on rabbits'hind thigs, Cryobiology, 33, 93-105.
- [20] Rabin e Julian e Olson et al., Long term follow-up post-cryosurgery in a sheep breast model, Cryobyology, 39, 29-46.
- [21] Rabin e Julian e Wolmark, 1999, Method and apparatus for heating during cryosurgery, US Patent 5, 899 897.
- [22] Rabin e Korin, 1993, An efficient numerical solution for the multidimensional solidification (or melting) problem using a microcomputer, Int. J. Heat mass Tans., 36, 673-683.
- [23] Rabin e Shitzer, 1998, numerical solution of the multidimensional freezing problem during cryosurgery, J. Biomech. Eng., 120, 32-37.
- [24] Rabin e Stahovich, 2002, The thermal effect of urethral warming during cryosurgery, CryoLetters, 23, 361-374.
- [25] Rubinsky e Gilbert e Onik et al., 1993, Monitoring cryosurgery in the brain and the prostate with proton NMR, Cryobiology, 30, 191-199.
- [26] Stahovich, 2000, LearnIT: an istance based approach to learning and reusing design strategies, J. Mech Design, 122, 249-256.
- [27] Stahovich e Bal, 2002, An inductive approach to learning and reusing design strategies, Res. Eng. Designe, 13, 109-121.
- [28] Weinbaum e Jiji, 1985, A new simpliefied bioheat equation for the effect of blood flow on local average tissue temperature, J. Biomech. Eng., 107, 131-136.
- [29] Wulff, 1974, The energy conservation for living tissue, Tans. Biomed. Eng., 21, 494.
- [30] Rabin e Stahovich, 2003, Cryoheater as a means of cryosurgey control, Phys. Med. Biol., 48, 619-632.
Capitolo 3.6
- [1] Fiala, 1998, Thesis, Leicester, Gran Bretagna.
- [2] Van Leeuwen et al., 2000, Pediatr. Res., 48, 351-356.
- [3] Van Lenthe e Hoogh et al., 2002, Temperature ditribution in the head during scalp cooling, Catharin-Ziekenhuis, Eindhoven.
Paragrafo 7
- [1] Anvari e Rastegar et al., 1994, Modelling of intraluminal heating of biological tissue: Implications for treatment of benign prostatic hyperplasia, IEEE Trans. Biomed. Eng., 41, 854-863.
- [2] Bracco e Mordon et al., 1992, Development and experimental in-vivo evaluation of mathematical modelling of coagulation by laser, Proc. SPIE, 1646, 138-149.
- [2b] Bracco, 1994, Development and experimental in-vivo evaluation of mathematical modelling of laser coagulation, Lasers Surg. Med., 14, 362-373.
- [3] Borrelli e Thompson et al., 1990, Time-temperature analysis of cell killing of NHK cells heated at temperature in the range of 43°C to 57°C, Int. J. Radiat. Oncol. Biol. Phys., 19, 389-399.
- [4] Brown, 1983, Phototherapy of tumours, World. J Surg.,7, 700-709.
- [5] Brown e Hunt, 1988, A comparison rate of clearance of xenon and pertecthnetate ion in murine tumors and normal leg muscles, Nucl. Med. Biol., 15, 381-390.
- [6] Croft e Lilley, Heat transfer calculation using finite difference equations, Essex.
- [7] Duck, 1990, Physical properties of tissue, Complete reference book.
- [8] Durdenstadt e Hamilton, 1976, Nuclear reactor analysis, New York.
- [9] Fahim e el-Sabbam, 1995, Hyperthermia induces ultrastructural changes in mouse plial microvessels, Anat. Rec., 242, 77-82.
- [10] Glenn eRastegar et al., 1996, Finite element analysis of temperature controlled coagulation in laser irradiated tissue, IEE Trans. Biomed. Eng., 43, 79-87.
- [11] Harries e Amin et al., 1994, Interstitial laser photocoagulation as a treatment for breast cancer, Br. J. Surg., 81, 1617-1619.
- [12] Hielscher e Alcouffe et al., 1998, Comparison of finite different transport and diffusion calculation for photon migration in homogeneous and heterogeneous tissues, Phys. Med. Biol., 43, 1285-12305.
- [13] IRCP, 1975, Report of the task group on reference man, IRCP publication 23.
- [14] Iizuka e Sherar et al., 1999, Optical phantom materials for near infrared laser photocoagulation studies, Laser Surg. Med., 25, 159-169.
- [15] Jacques e Newman et al., 1991, Thermal coagulation of tissues: liver studies indicate a distribution of rate parameters, not a single rate parameters, describes the coagulation process, Advances in biological heat and mass Transfer (ASME), 71-73.
- [16] Jacques e Rastegar et al., 1996, The role of dynamic changes in blood perfusion and optical properties in laser coagulation of tissue, IEEE J. SEL. Top. Quantum Electron., 2, 922-933.
- [17] Jaywant e Wilson et al., 1983, Temperature dpendent changes in optical absorption and scattering sectra of tissue: correlation with ultrastructure, Proc. SPIE, 1882, 218-228.
- [18] Johnson e Eyrina et al., 1974, The teory of rate processes in biology and medicine, New York.
- [19] Kim e Jacques et al., 1995,the role of dynamic changes in blood perfusion and optical properties in thermal coagulation of the prostate, Proc. SPIE 2391, 443-448.
- [20] Kim e Jacques et al., 1996, Nonlinear finite elements analysys of the role of dynamic changes in blood perfusion and optical properties in laser coagulation of tissue, IEEE J. Sel. Top. Quantum Electron., 2, 922-933.
- [21] Kolios e Worthington et al., 1999, An investugation of the flow dependence of temperature gradients near large vessels during steady state and transient tissue heating, Phys. Med. Biol., 44, 1479-1497.
- [22] London e Glinsky et al., 1995, Coupled light transport-heat diffusion model for laser dosimetry wuth dynamic optical properties, Proc. SPIE, 2391, 434-442.
- [23] McKenzie, 1990, Physics of thermal processes in laser tissue interaction, Phys. Med. Biol., 35, 1175-1209.
- [24] Mordon e Desmettre, 1997, Thermal damage assesment of blood vessels in hamster skin flap model by fluorescent measurement of a lyposome dye system, Laser Surg. Med., 20, 131-141.
- [25] Patankar, 1980, Numerical heat transfer and flui flow, Washington DC, Hemisphere.
- [26] Patterson e Wilson et al., 1991, The propagation of optical radiation in tissue I, Laser Med. Sci., 6, 155-168.
- [28] Pickering, 1998, Optical property changes as a result of protein denature in albumen and yolk, J. Photochem. Photobiol. B: Biol., 16, 101-111.
- [29] Pickering e Posthumus et al., 1994, Continuos measurement fo the heat-induced changes in optical properties of rat liver, Laser Surg. Med., 15, 200-205.
- [30] Prudhomme e Tang et al., 1994, Diode laser and interstitial hyperthermia against ht29 colonic cancer. Effect of power settings on necrosis size, Proc. SPIE 2327, 283-286.
- [31] Rastegar e Kim et al., 1992, Role of temperature dependence of optical properties in laser irradiationof biological tissue, Proc. SPIE 1646, 228-231.
- [32] Reinhold e Endrich, 1986, Tumor microcirculation as a target for hyperthermia, Int. J. Hyperthermia, 2, 111-137.
- [33],[35] Roggan e Dorschel et al. 1995, The optical properties of biological tissue in the near infrared wavelenght range-review and measurement, Laser Induced Interstitial Thermotherapy, 10-44, 114-156.
- [34] Roggan e Muller, 1994, 2D computer simulation for real time irradiation planning for laser.induced interstitial thermotherapy, Proc. SPIE 2327, 242-252.
- [36] Salemen e Moriyama et al., 1989,Clebral blood flow and the thermal properties of the brain: a preliminary analisys, J. Neurosurg., 70, 592-598.
- [37] Spells, 1960, The thermal conductivities of some biological fluids, Phys. Med. Biol., 5, 1399-1453.
- [38] Star, 1995, Diffusion theory of light transport, Optical-Thermal Response of Laser Irradiated Tissue, New York: Plenum, 131-205.
- [39] Sturesson e Andersson, 1996, Theoretical analysis of transurethral laser-induced thermo-therapy for treatment of benign prostatic hyperplasia, Med. Phys., 24, 461-470.
- [40] Sturesson e Andersson, 1997, Tissue temperature control using a water-cooled applicator: implication for transurethral laser-induced thermotherapy of benign prostatic hyperplasia, Med. Phys., 24, 461-470.
- [41] Tracz e Wyman, 1992, Magnetic resonance imaging of interstitial laser photocoagulation in brai, Laser Surg. Med., 12, 165-173.
- [42] Vitkin e Wilson et al., 1995, Analisys of layered scattering materials by pulsed photothermal radiometry: application to photon propagation in tissue, Appl. Opt., 34, 2973-2982.
- [43] Vogl e Mack et al., 1997, Magnetic resonance imaging-guided abdominal interventional radiology: laser-induced thermotherapy of liver metastases, Endoscopy, 29, 577-583.
- [44] Welch, 1984, The termal response of laser irradiated tissue, IEEE J. Quantum Electron., 20, 1471-1481.
- [45] Welch e van Gemert, 1995, Optical-thermal response of laser.irradiated tissue, New York: Plenum.
- [46] Whelan, 1996 Dynamic modeling of ILP in soft tissues, PhD Thesis, Mcmaster University, Ontario, Canada.
- [47] Whelan e Wyman, 1999, Modeling of interstitial laser photocoagulation: implication for lesions formation for liver in vivo, Lasers Surg. Med., 24, 202-208.
- [48] Whelan e wyman et al., 1995, Investigations of large vessel cooling during interstitial laser heating, Med. Phys., 22, 105-115.
- [49] Williams e Leggett, 1989, Reference values for reting blood flow to organs of man, Clin. Phys. Physiol. Meas., 10, 187-217.
- [50] Wyman e Patterson et al., Similarity relations for the interaction parameters in radiation transport and their applications, Appl. Opt., 28, 5243-5249.
- [51] Wyman e Whelan, 1994, Basic optothermal diffusion theory for interstitial laser photocoagulation, Med. Phys., 21, 1651-1656.
- [52] Wyman e Whelan et al., 1992, Interstitial laser photocoagulation, Lasers Surg Med. ,12 , 659-664
- [53] Iizka, Vitkin, Kolios e Sherar, 2000, The effects of dynamic optical properties during interstitial laser photocoagulation, Phys. Med. Biol, 45, 1335-1357.
Ipertermia
Storia
Fin dall'antichità, curare malattie con il calore, prescrivendo bagni caldi o poggiando elementi particolarmente caldi a contatto con il corpo, è stato un rimedio che portava risultati concreti. Il perché, che allora era sconosciuto, viene spiegato oggi constatando l'effettivo aumento della risposta immunitaria.
L'idea di utilizzare l'ipertermia come cura antitumorale risale al 1866 con le osservazioni del medico tedesco W. Bush. Egli aveva notato come il sarcoma dell'erisipela, una malattia della pelle fortemente contagiosa, sparisse dopo che il paziente veniva colto da febbre alta. Alla fine dell'ottocento anche altri medici europei e americani notano il regresso di alcuni tumori dopo febbri molto alte.
Altri ricercatori, nello stesso periodo, come W. B. Coley di New York, estraggono le tossine dal batterio dell'erisipela, e le inoculano nei malati di sarcoma inoperabile, nella speranza di stimolare le difese immunitarie. Così, fin dall'inizio, l'ipertermia moderna viene a marciare a fianco dell'immunoterapia.
La sperimentazione s'intensifica nel 1898, il primo ad utilizzare l'ipertermia locale è il ginecologo svedese Westmark: segnala i benefici effetti nell'applicazione locale di calore sui carcinomi inoperabili della cervice uterina.
Sfortunatamente, a causa delle guerre che infiammano l'Europa nei primi decenni del novecento, la maggior parte di questi studi vengono bruscamente interrotti.
Negli anni attorno al 1960, l'impennata dei tumori nelle statistiche di mortalità per malattia riporta in auge le sperimentazioni che avevano dimostrato l'effetto tumoricida del calore. Nel 1962 l'americano George Crile jr. prova questo effetto su i tumori trapiantabili del ratto; egli scopre che, innalzando di un solo grado la temperatura, si riesce a distruggere le cellule tumorali, oppure il rigetto del tumore avviene in metà tempo.
Da allora, nei congressi internazionali di Washington nel 1975, Essen nel 1977, Fort Collins nel 1980 e Aarhus nel 1984, vi è un susseguirsi di studi e indagini. Da questi studi nasce la macchina per ipertermia loco-regionale del prof. Harry Le Veen, ripresa e migliorata dal servizio oncologia diretto dal prof. Paolo Pontiggia presso la clinica "Città di Pavia".
I tumori in Italia
In Italia la speranza di vita ha raggiunto 83 anni per la donna e 76,7 per gli uomini, che confrontata su scala planetaria è tra le più alte. Tra i fattori che influenzano la nostra popolazione, il principale è sicuramente l'alimentazione di tipo mediterraneo; il consumo giornaliero di frutta, verdura, cereali e legumi, fornisce uno scudo contro la formazione di tumori nel nostro organismo e in particolare dell'apparato digerente.
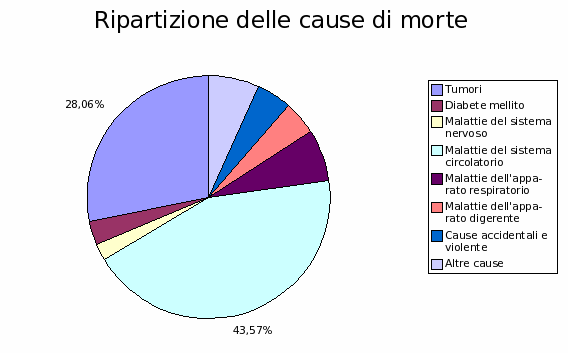
Fig. 67Cause di morte in Italia nel 2001, il diagramma mostra la percentuale di ogni principale categoria rispetto a tutti i decessi avvenuti nel 2001. I dati sono forniti dall' I.S.T.A.T.
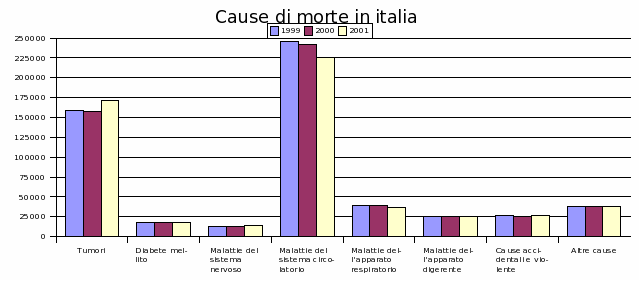
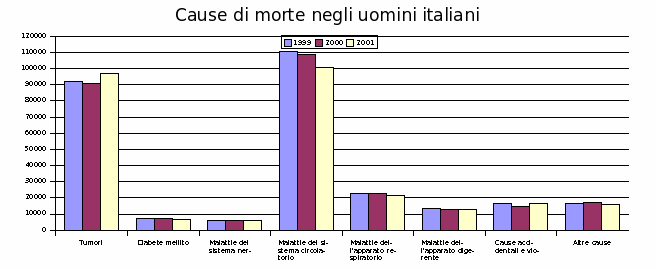
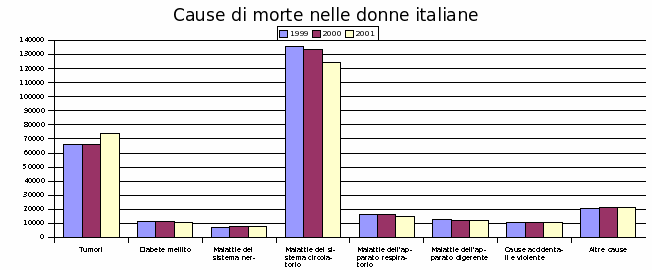
Nonostante ciò l'imitazione di modelli sbagliati di nutrizione proveniente dagli U.S.A., come il fast food costituito solo da un panino e patatine fritte, l'eccessivo uso di sale nel cibo, l'assunzione eccessiva di zuccheri tramite bevande e dolci, sono una delle cause maggiori di cancro in tutti i paesi industrializzati, anche il nostro.
Le morti per neoplasie in Italia hanno raggiunto quasi il 30% (v. Fig. 67) e la miglior cura a tutt'oggi è la prevenzione attraverso un'alimentazione coscienziosa e la pratica regolare di attività fisica.
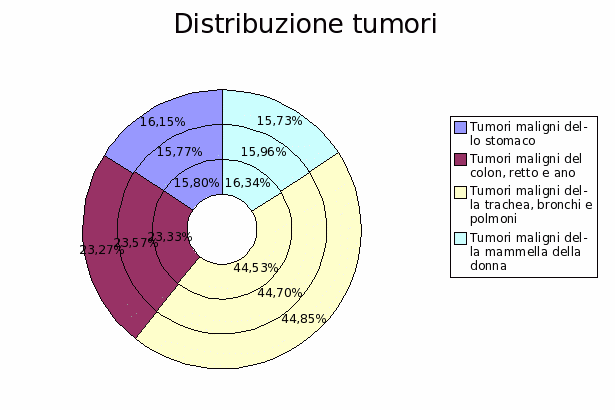
Fig. 68 Diagramma delle percentuali di tumori come causa di morte in Italia. Il settore circolare più esterno rappresenta la casistica del 1999, il settore centrale la casistica del 2000 e il più interno quella del 2001.
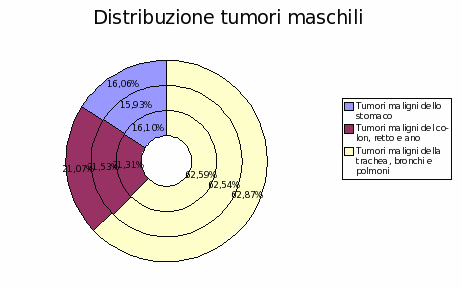
Fig. 69 Distribuzione dei tumori mortali in \\ Italia dal 1999, cerchio più esterno, al 2001, \\ cerchio più interno. In alto la distribuzione \\ per il sesso maschile, in basso quella per il \\ sesso femminile; si vede come, nonostante \\ lo stato metta in atto tante campagne \\ riguardo la prevenzione del tumore al seno, \\ esso rimanga, secondo le statistiche, il \\ tumore più mortale per la donna.

Agli inizi degli anni novanta la percentuale di morti per tumore al polmone era scesa fortemente, grazie alle campagne antifumo. In seguito, un certo fatalismo dilagante ha fatto rialzare tale percentuale toccando oggi il 62% dei tumori mortali per gli uomini. Ma un dato ancora più preoccupante riguarda le statistiche femminili, il tumore che ha causato più morti negli ultimi anni è il cancro alla mammella, generalmente facilmente diagnosticabile; basterebbe effettuare le analisi di routine, come la mammografia, per diminuire fortemente il numero di decessi in Italia.
L'altra grande malattia, che crea il maggior numero di morti ogni anno, è quella di tipo cardiocircolatorio. Ma vi è una profonda differenza con le malattie di tipo tumorale, negli ultimi 30 anni la mortalità è scesa del 30% una volta iniziata la cura, non così per i tumori.
Qualunque siano i motivi della crescita dei tumori nel nostro paese (v. Fig. 70), essi rimangono la seconda causa di morte in Italia, quindi la ricerca, sia medica per trovare delle cure adatte, che tecnologica per metterle in atto, non deve essere assolutamente frenata. Inoltre bisogna essere sempre aperti ad una discussione sui metodi per curare le neoplasie, sperimentando sempre in nuovi campi e nuove direzioni.
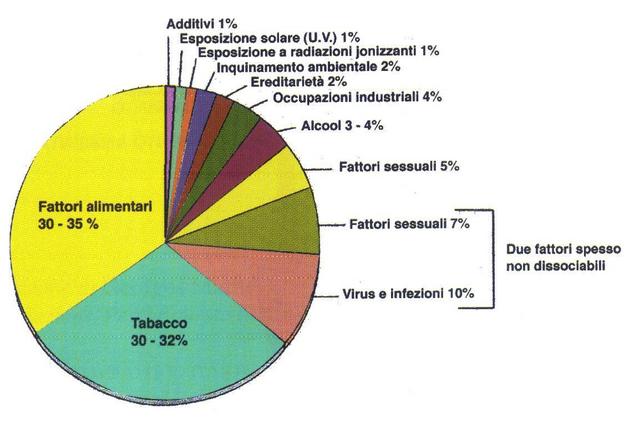
Fig. 70 Distribuzione delle cause dei tumori in Italia.
I metodi oggi
Quando un medico decide la terapia da affrontare con un paziente malato di cancro, generalmente egli sceglie fra tre strade principali:
- Chirurgia
- Radioterapia
- Chemioterapia
La scelta di solito avviene nel ramo di specializzazione del medico, ma ognuna di esse ha i suoi pregi e suoi limiti.
La chirurgia si prepone come scopo di eliminare, attraverso l'uso del bisturi, il tumore all'interno dell'organismo. Molte volte la posizione della neoplasia è talmente in profondità o in zone talmente delicate, che non è pensabile l'intervento. Inoltre sia il rischio di morte per emorragia che la non completa eliminazione del tumore, che di solito porta alla formazioni di metastasi, rimangono molto alte.
La radioterapia, che si è affermata dopo la seconda guerra mondiale, permette di distruggere masse tumorali dove non è possibile arrivare con il bisturi, ma d'altro canto si provocano ingenti danni ai tessuti sani circostanti, con il rischio di creare nuovi tumori.
La chemioterapia è molto efficace in settori specifici, come:
- leucemie
- linfomi
- tumori dell'infanzia
- osteosarcoma degli adolescenti
- tumori ai testicoli
e in parte anche per i tumori dell'ovaio in età adulta e del corioncarcinoma. La chemioterapia non arriva mai ad uccidere 100% delle cellule tumorali, e inoltre il tumore può sviluppare un'immunità al farmaco, o a gruppi di farmaci, fino a diventare del tutto immune alla chemioterapia; in questo caso si sviluppa la cosiddetta "multipla comune", che ha origini genetiche. Infine la chemioterapia è più dannosa per le cellule sane che per quelle malate, per cui va compiuta a cicli e cambiando farmaco tra un ciclo e il successivo. Generalmente la chemioterapia dà grossi risultati per le patologie che affliggono le cellule del sangue, ma è un errore riportare gli stessi risultati per la cura dei tumori solidi; tra le due malattie vi è una grossa differenza nella struttura biologica e nelle caratteristiche vascolari.
Inoltre sia la radioterapia che la chemioterapia hanno effetti tossici sui pazienti, per questo motivo non possono essere utilizzate per lunghi periodi, senza tenere in conto il costo economico per il malato.
Quando un tumore viene diagnosticato, le cellule tumorali hanno già proliferato. Il paziente che va da un medico deve avere chiaro che esista il rischio di incorrere in una ricaduta della malattia, anche dopo una terapia molto gravosa.
Il calore come trattamento antitumorale
Ancora oggi considerata come una cura di "serie b", l'ipertermia nel mondo sta mostrando sempre più risultati positivi nella cura del cancro. Lo scopo dell'ipertermia è di aumentare la reazione delle difese immunitarie, che in un corpo sano tendono autonomamente a proteggere l'organismo distruggendo le cellule tumorali, inoltre esistono dei meccanismi di controllo all'interno del DNA che decretano la morte della cellula se non si sviluppa in modo normale. In un corpo affetto da cancro invece l'effetto dei globuli bianchi, dei macrofagi e di tutte la altre difese dell'organismo, non sono sufficienti a contrastare la crescita del tumore.
L'ipertermia porta la temperatura delle cellule attorno ai 41- 43 °C, attivando così i geni che ordinano alle cellule di suicidarsi utilizzando quel fenomeno biologico chiamato "apoptosi"13. In pratica avviene la rottura del DNA nucleosomiale; per favorire il processo negli ultimi anni viene affiancata da alcuni farmaci chemioterapici.
Nei casi in cui sia tutto necessario un trattamento "total body", cioè su tutto l'organismo, si ottiene la morte anche di cellule sane, ma queste risultano modeste rispetto a quelle neoplastiche. Per esempio, se il trattamento viene utilizzato insieme all'interferone, il calore è in grado di eliminare il cromosoma PH1, normalmente legato alla leucemia mieloide cronica.
Insieme alla terapia ipertermica sono usualmente associate, a seconda della malattia:
- Chemioterapia: impedisce alle cellule neoplastiche di riprodursi (proliferare).
- Antagonisti dei fattori di crescita (somatostatina)
- Immunoterapia: attivando la risposta immunitaria
Uno degli effetti principali prodotti dall'ipertermia è un'imponente reazione immunitaria, proprio per questo motivo viene spesso affiancata dall'immunoterapia; a livello generale potenzia la reazione immunitaria stimolando i linfociti e macrofagi con microbi come il BCG14, la bestatina, la tuftsina, l'interleuchina 2 o l'interferon gamma15.
Nelle applicazioni di ipertermia generale, cioè "total body" oggigiorno si seguono due strade. La prima consiste nel portare la temperatura del paziente a 40°C e mantenendola a questi livelli per alcune ore; in pratica si crea artificialmente una forte febbre senza interromperla. La seconda consiste nel mantenere il corpo a 42°C per un'ora solamente.
Il primo tipo di applicazione è preferibile, perché stimola i linfociti, in particolare quelli citotossici, cioè che uccidono le cellule tumorali, e frena i "suppressor" che reprimono la risposta immunitaria. Condurre una ipertermia ad una temperatura superiore ai 42°C può invece mitigare la risposta immunitaria, e non viene mai utilizzata con l'eccezione di quella transrettale per ridurre il volume della prostata, raggiungendo i 45°C si spingono al suicidio anche cellule che non sono ancora maligne.
Le cellule tumorali hanno un meccanismo di riparazione dei danni DNA molto limitato, per questo i danni provocati dal calore sono irrimediabili. Al contrario nelle cellule sane il meccanismo di riparazione cellulare è molto efficiente. Inoltre il meccanismo di riparazione cellulare ha bisogno di una quantità di energia che le cellule tumorali non sono in grado di fornire, poiché le cellule tumorali trasformano il glucosio in acido lattico con un processo la cui resa energetica è molto scadente.
Il calore, per giunta, che nei tessuti sani aumenta l'irrorazione a causa della vasodilatazione, nei tessuti tumorali ostacola la circolazione. Quindi le cellule sane possono raffreddarsi più facilmente, mentre quelle malate si ritrovano con l'impossibilità di smaltire il calore, e per di più in carenza di ossigeno. Sfortunatamente la carenza di ossigeno può anche spingere alcune cellule tumorali a migrare verso altri organi, formando così metastasi; questo rischio non va mai sottovalutato.
L'ipertermia e i suoi limiti
Il trattamento ipertermico non ha una sola metodologia, ma presenta diverse applicazioni a seconda delle esigenze richieste dal tumore:
- Ipertermia localizzata: si fa salire la temperatura dell'organo interessato o del tessuto. Per i tumori più superficiali si utilizzano le microonde, per quelli più profondi le radiofrequenze e gli ultrasuoni per i tessuti di consistenza omogenea. Si tratta del metodo più utilizzato nella pratica clinica, che è in continuo miglioramento.
I limiti legati agli ultrasuoni sono molteplici, generalmente vengono utilizzate frequenze variabili tra 0,3MHz e 3MHz, ma la differenza di penetrazione dipende dal tessuto, nel grasso con 1MHz la profondità è di 31cm mentre nel muscolo si raggiungono a malapena i 4 cm. Grossi problemi si hanno anche con le interfacce aria-tessuti molli e tessuti molli-muscolo, poiché generano la riflessione quasi completa dell'energia ultrasonica; per di più, l'alto assorbimento a livello osseo degli ultrasuoni genera un dolore intollerabile nel 50% dei pazienti. - Ipertermia interstiziale: nella cute o nello strato sottocutaneo vengono inserite delle antenne; contemporaneamente dall'esterno vengono mandate microonde. Con questo metodo possono essere trattati solo tumori superficiali o semisuperficiali, cioè a circa 2-4 cm di profondità. Se in sequenza si pratica della radioterapia il suo effetto risulta notevolmente potenziato.
- Ipertermia perfusionale: in passato era il tipo d'ipertermia più praticato. E' stato sviluppato soprattutto contro i tumori, primari o metastatici, degli arti. La perfusione può essere praticata mediante derivazione esterna del circolo ematico, al liquido di perfusione, come sangue, derivati o sostituti del sangue, vengono di solito aggiunti chemioterapici. L'obiettivo è anche di realizzare alte concentrazioni di farmaco antitumorale nel tessuto perfuso. Sono in corso interessanti esperimenti combinando l'ipertermia con la chemioterapia selettiva intrarteriosa nei tumori epatici.
- Ipertermia infusionale: l'infusione si pratica quando c'è da curare un organo cavo, per esempio il peritoneo, la vescica o la pleura, in presenza o meno di versamento. Si combinano soluzioni riscaldate e infusioni di farmaci antitumorali. Promettenti risultati sono stati ottenuti nei tumori allo stomaco e all'ovaio, nei casi di recidivanti dopo la chemioterapia. Discorso a parte merita la tecnica della perfusione peritoneale, inventata dal professore giapponese Shigeru Fujimoto, che lavora al centro di Chiba-Shi16. Prende il nome di infusione peritoneale dal peritoneo, la membrana che riveste la cavità addominale; un catetere viene introdotto nell'addome e vi si fa circolare liquido riscaldato in una macchina esterna. La perfusione risulta molto efficace per tutti gli organi addominali.
- Ipertermia sistemica: se la neoplasia è disseminata, si interviene riscaldando tutto il sangue del paziente. Questo tipo d'ipertermia si pratica facendo circolare il sangue all'esterno del corpo. Mentre il sangue circola all'esterno, ne viene innalzata la temperatura per mezzo di scambiatori di calore. Sistemi alternativi prevedono l'uso di radiofrequenze mediante applicatori esterni, oppure raggi infrarossi prodotti da lampade. Il limite maggiore di questi alternativi è la difficoltà di raggiungere temperature adeguatamente elevate, vale a dire 42°C, senza rilevanti effetti secondari. L'ipertermia sistemica richiede di solito anestesia generale ed è praticata solo quando apparato circolatorio e respiratorio del paziente funzionano normalmente.
Ogni terapia presentata ha i suoi limiti, nel caso degli ultrasuoni ancora non è possibile trasmetterli in maniera omogenea in organi cavi e in organi che contengano aria. Le microonde, che vengono utilizzate a frequenze maggiori di 300MHz, rendono bene, ma non possono penetrare più di 3-4cm. Le più usate sono le onde radio, sviluppate da antenne sotto forma di piastra, riescono a scendere in profondità nei tessuti e possono riscaldare organi interni come polmoni, pancreas, fegato e cervello. Un accorgimento essenziale sta nell'evitare il riscaldamento del grasso sottocutaneo; il grasso, infatti, è molto ricco di acqua e perciò di dipoli, che, quindi, verrebbero a surriscaldarsi molto facilmente con le onde radio. Per evitare ciò si usa interporre tra antenna e cute una sacca termica di protezione raffreddata.
Le percentuali di riuscita nei casi di tumore al polmone si attestano attorno al 40%, mentre per il tumore alla mammella si è raggiunto il 70%. Ma queste percentuali cadono anche di molto se il sistema immunitario del paziente è fortemente danneggiato, e questo accade se:
- ha praticato precedentemente terapie distruttive
- è stato colpito da gravi infezioni (in particolar modo HIV)
- debolezza congenita del sistema immunitario
- la malattia tumorale ha raggiunto uno stadio molto avanzato devastando tutto l'organismo
E' evidente che l'ipertermia, utilizzando come mezzo di controllo contro il proliferarsi del tumore, il sistema immunitario, ha bisogno di esso. La lamentela più frequente da parte dei medici che praticano l'ipertermia è che i pazienti che curano generalmente hanno provato terapie precedenti, spesso chemioterapie devastanti, e solo dopo aver perso ogni speranza con tali terapie si sono affacciati all'ipertermia. E' una convinzione molto diffusa che se la maggior parte dei pazienti provasse l'ipertermia, anche solo come trattamento pre e post chirurgico, le percentuali salirebbero di molto.
I mezzi per praticare l'ipertermia
Ipertermia localizzata
In Italia, la pratica clinica più consolidata è di creare uno stato d'ipertermia all'interno del paziente attraverso l'uso di onde radio. La macchina che regola la potenza per le antenne è mostrata in Fig. 71. Da essa è possibile regolare, oltre che la potenza, sia la frequenza delle onde, che la durata del trattamento.
Fig. 71 Macchina per ipertermia, prodotta dalla Sicrotherm, Vigevano. Questo modello è attualmente utilizzato nel centro di ipertermia dell'università Tor Vergata di Roma.
Come già descritto nel paragrafo precedente, a seconda della frequenza delle onde elettromagnetiche utilizzate, si riesce a riscaldare il corpo ad una differente profondità (v. Fig. 72). Le onde che sono più facili da controllare, e quindi da mettere a fuoco nel punto desiderato sono quelle ad una frequenza più alta, cioè superati i 400 MHz, mentre utilizzando frequenze più basse risulta più difficile raggiungere la zona da trattare senza ricorrere a potenze eccessivamente elevate o evitando di riscaldare altri tessuti.
Fig. 72 Profondità della penetrazione delle onde elettromagnetiche a seconda della frequenza. Si noti l'uso di due antenne al diminuire della frequenza.
Fig. 73 Profondità del fuoco delle onde a seconda del diametro delle antenne. I rettangoli azzurri rappresentano le sezioni dei cuscini a 10°C per evitare bruciature nella zona di contatto pelle-antenna.
Le placche poste una di fronte all'altra sono di tipo capacitivo per variare la profondità del fuoco vengono accoppiate antenne di diverso diametro, come mostrato in Fig. 73. Per evitare di surriscaldare eccessivamente la zona di contatto con l'antenna, che in un individuo normale è costituito da grasso, un tessuto ad alto contenuto di acqua che tende a riscaldarsi più dei tessuti circostanti, viene generalmente interposta una sacca di raffreddamento, generalmente mantenuta a 10°C; ogni sacca viene controllata separatamente (v. Fig. 74).

Fig. 74 Antenne tonde e quadrate con relative sacche di raffreddamento. I diametri di quelle tonde sono rispettivamente 80, 120, 180, 260mm; le dimensioni di quelle rettangolari sono 320x440mm e 200x440mm.
Le antenne sono delle spirali che generano un campo elettromagnetico le cui linee sono coassiali alla zona da trattare, sono flessibili e deformabili adattandosi alle varie parti del corpo, come mostrato in Fig. 76. Con questo tipo di antenne è possibile trattare zone con scarso pannicolo adiposo o neoplasie intraddominali con 13,56MHz.
Accoppiando più coppie di antenne è possibile riscaldare organi molto profondi senza intaccare i tessuti superficiali, utilizzando un'unica coppia di antenne servirebbe una potenza talmente alta per contrastare l'assorbimento da parte dei tessuti più esterni tale da carbonizzarli.
Fig. 75 Schema dell'applicazione di più coppie di antenne contemporaneamente.
Per trattare zone con forme particolari come il collo, il cavo ascellare o l'inguine, sono state progettate apposite antenne concave o convesse, che non solo si adattano meglio parte del corpo da trattare, ma la irradiano meglio, come mostra la Fig. 76 a destra.

Fig. 76 A sinistra un particolare delle antenne che mostra come siano deformabili. A destra antenne concave e convesse con il supporto in legno per la testa che assicura una pressione costante nel tempo delle antenne sul corpo.
Per rendere più semplice l'applicazione dell'antenna in una qualunque parte del corpo è in studio un manipolo aeromobile, mostrato in Fig. 77, si vede come tutto il sistema di posizionamento sia costituito in legno, per evitare distorsioni delle linee del campo elettromagnetico.
Fig. 77 Manipolo aeromobile, in sperimentazione presso la Sincrotherm di Vigevano.
Anche il lettino e tutti i mobili nella stanza dove si pratica l'ipertermia sono usualmente di legno, il lettino soprattutto rischierebbe di surriscaldarsi fino ad ustionare il paziente se fosse fatto di metallo (v. Fig. 78).

Fig. 78 Porta antenna, porta cavi, lettini e mobili in legno utilizzati nelle stanze per ipertermia.
Allo scopo d'incrementare lo stato generale di febbre artificiale è possibile applicare durante il trattamento una vasca ad emissione d'infrarossi che genera un ulteriore flusso di calore, come esposto in Fig. 79.

Fig. 79 Vasca ad emissione d'infrarossi.
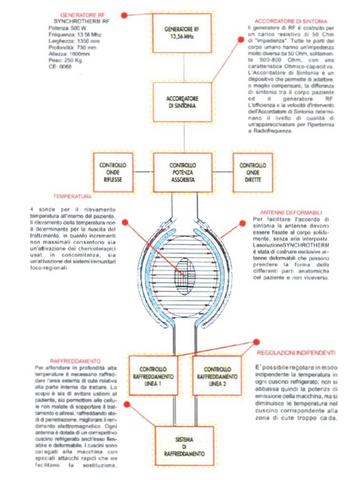
Fig. 80 Diagramma a blocchi rappresentante il funzionamento della macchina per ipertermia.
La macchina nel suo complesso funziona secondo il diagramma a blocchi di Fig. 80: il generatore è composto da valvole elettroniche che generano correnti oscillanti ad una data frequenza, nell'esempio 13,56MHz. Le caratteristiche essenziali che determinano il funzionamento delle valvole sono tre:
- il fattore di amplificazione
- la resistenza interna
- la mutua induttanza
Il fattore di amplificazione 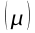 varia a seconda del tipo di valvola. Ciascun valore dipende a sua volta dalla struttura di controllo della griglia della valvola stessa. Con l'aumentare dell'azione schermante della griglia aumenta anche il fattore di amplificazione.
varia a seconda del tipo di valvola. Ciascun valore dipende a sua volta dalla struttura di controllo della griglia della valvola stessa. Con l'aumentare dell'azione schermante della griglia aumenta anche il fattore di amplificazione.
La resistenza interna 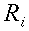 è data dal rapporto tra una piccola variazione della tensione in ingresso, e la variazione della corrente d'ingresso da essa generata, quando la tensione del generatore è costante. La tensione della griglia alla quale si genera la resistenza interna prende il nome di "punto di lavoro". La resistenza interna aumenta con l'aumentare della superficie emittente e diminuisce con il diminuire della distanza tra le varie superfici emittenti.
è data dal rapporto tra una piccola variazione della tensione in ingresso, e la variazione della corrente d'ingresso da essa generata, quando la tensione del generatore è costante. La tensione della griglia alla quale si genera la resistenza interna prende il nome di "punto di lavoro". La resistenza interna aumenta con l'aumentare della superficie emittente e diminuisce con il diminuire della distanza tra le varie superfici emittenti.
La mutua conduttanza è definita come il rapporto di una piccola variazione della tensione d'ingresso e la variazione della tensione che l'ha prodotta, sempre che rimanga costante la tensione del generatore. La mutua conduttanza fornisce un'indicazione sommaria di una data valvola.
L'accordatore di sintonia ha lo scopo di mettere in sintonia, ossia in risonanza, i segnali a radiofrequenza emessi dalle due antenne. Esso ha il compito di accordare l'apparecchio sulla lunghezza d'onda del segnale ed è detto "circuito oscillatorio". L'accordatore di sintonia è formato da due parti molto importanti:
- la bobina di accordo
- il condensatore variabile
La bobina d'accordo è formata da un certo numero di spire di filo di rame isolato, avvolte sullo stesso tubo isolante sopra il quale si trova la bobina d'antenna. Le due bobine, quella d'antenna e quella d'accordo, si trovano a breve distanza l'una dall'altra, per cui la tensione oscillante presente ai capi della bobina d'antenna viene trasferita ai capi della bobina di accordo, senza che vi sia collegamento diretto tra di esse, per effetto induttivo. L'insieme delle due bobine forma il trasformatore d'alta frequenza, del quale la bobina di entrata viene detta primario, e quella di accordo secondario.
Il condensatore variabile, invece, è formato da un certo numero di lamine mobili in presenza di altre fisse; le prime formano lo statore. La sintonia è ottenuta variando la posizione delle lamine mobili, mediante la manopola di sintonia.
La funzione dei tre circuiti di controllo (onde riflesse, potenza assorbita, onde dirette) è quella di evitare il sovraccarico delle antenne, effettuando un controllo ad anello chiuso reazionato sui blocchi precedenti.
Ipertermia perfusionale
Come descritto nel paragrafo 4.5, per praticare questo tipo d'ipertermia bisogna conoscere il sistema circolatorio che avvolge e attraversa il tumore, poiché c'è la necessità d'individuare un'arteria che affluisca verso il tessuto o l'organo da trattare. Questo tipo d'ipertermia garantisce sia un uniforme riscaldamento dell'organo, sia di conoscere l'effettiva temperatura a cui si trova l'organo riprendendo il sangue da una vena che esce dall'organo stesso e misurandone la temperatura.
Lo schema di funzionamento del sistema perfusionale è rappresentato in Fig. 81. Il sangue, mosso attraverso una pompa, viene prelevato a valle dell'organo e ne viene misurata la temperatura, in uno scambiatore a controcorrente il sangue raggiunge la temperatura di 40-42°C, e successivamente viene reintrodotto nel paziente in un'arteria che si affaccia sull'organo da trattare.
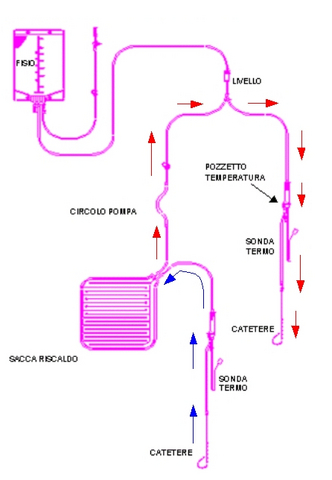
Fig. 81 Perfusione a due vie, le frecce blu indicano il percorso seguito dal sangue più freddo, quelle rosse dal sangue riscaldato.
E' anche possibile applicare sia la radiofrequenza che la perfusione, nel caso di organi con grandi dimensioni; lo schema in quest'ultimo caso è in Fig. 82.
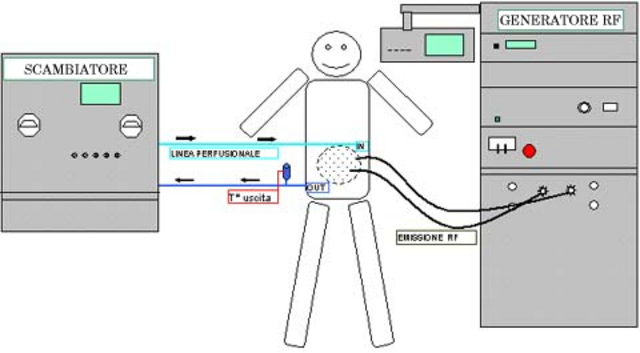
Fig. 82 Schema della macchina perfusionale accoppiata con il generatore di radiofrequenze.
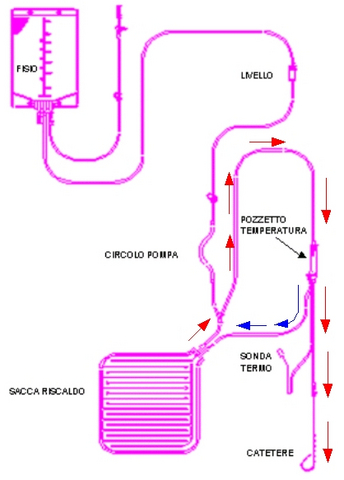
Fig. 83 Schema del sistema perfusionale ad una sola via.
Di tipo sperimentale è la perfusione ad una sola via, dove verrebbe iniettata una soluzione fisiologica, con opportuni antitumorali, solo in entrata. Lo schema è in Fig. 83.
Ipertermia ai polmoni
E' in fase di studio ad Amburgo una nuova macchina capace di praticare l'ipertermia per le zone polmonari evitando l'annoso problema del raffreddamento dovuto al respiro del paziente. Con questa macchina sarebbe possibile provocare un'ipertermia globale di entrambi i polmoni, o solamente di uno, mantenendo costante la temperatura all'interno di essi.
La macchina nel suo complesso sarebbe costituita da due parti, la prima un normale generatore di radiofrequenze per l'ipertermia localizzata, la seconda un generatore di aria calda che porta la temperatura dall'aria respirata dal paziente fino a 65°C, mescolandola con opportune dosi di farmaci. Lo schema è esposto in Fig. 84.
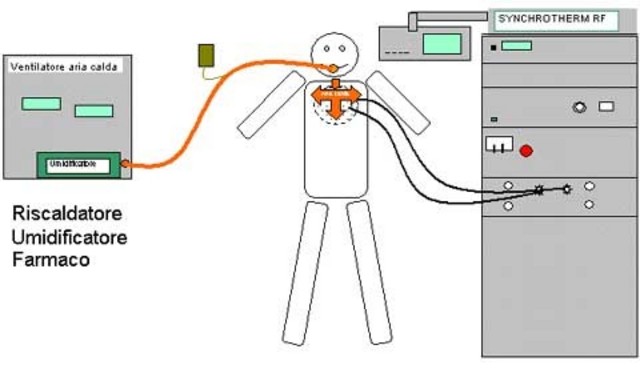
Fig. 84 Schema dell'apparecchio per l'ipertermia ai polmoni.
Ipertermia con gli ultrasuoni utilizzando scanner a matrice e una movimentazione meccanica
Nelle pagine precedenti è sono stati descritti i limiti dell'applicazione degli ultrasuoni con l'ipertermia, in questo paragrafo si esaminerà una simulazione che cerca di ovviare a tali inconvenienti.
Gli scanner elettronici sono particolari trasduttori capaci di variare la profondità del fuoco degli ultrasuoni senza necessità di una movimentazione meccanica. Il trasduttore è formato da una matrice di traduttori più piccoli che vengono attivati in un ordine tale da creare un fronte d'onda, il cui fuoco si concentri nel punto desiderato. Le forme della matrice per applicazioni d'ipertermia, negli ultimi anni, sono state le più svariate: ad anello [17], a settori concentrici [28], sferica [7] e cilindrica [9], solo per citarne alcune. Sfortunatamente è stato dimostrato dal prof. Lin [18] che l'apertura acustica, e quindi l'area della matrice, a causa della conformazione dei tumori, dell'attenuazione e per avere un'opportuna distribuzione di temperatura, non può superare una certa dimensione. Limitare l'apertura acustica limita fortemente anche la dimensione del tumore da curare, ovvero tra i 2x2x4 mm ai 10x10x20 mm. Una macchina costituita da tale trasduttore è esposta in Fig. 85.
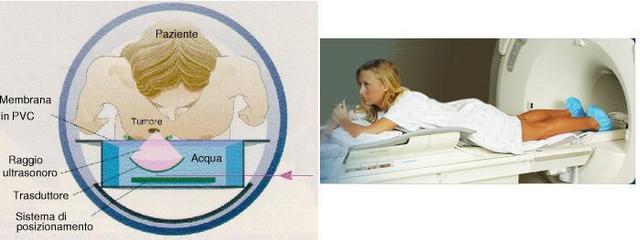
Fig. 85 Apparato per il trattamento degli ultrasuoni, con trasduttore a scanner elettronico. Questa particolare macchina non viene utilizzato per l'ipertermia, ma per coagulare un tumore all'interno dell'organismo.
La tecnica presentata nelle pagine seguenti è un ibrido, perché utilizzando una matrice elettronica si accoppierà una movimentazione meccanica tale da passare dalla cura di punti all'interno dell'organismo, a vere e proprie zone tridimensionali. La matrice unidimensionale (1D) è capace di concentrare le onde su un piano (2D), tutto il sistema viene mosso lungo un'asta che distribuisce questi punti lungo un solido tridimensionale (3D).
Descrizione del sistema
Un diagramma del funzionamento della macchina è esposto in Fig. 86. Il sistema consiste in un trasduttore elettronico a matrice e due meccanismi di movimento controllati. In Fig. 86(a) si vede che la matrice di trasduttori è posta su un'asta e grazie ad un motore può scorrere lungo quest'asta. Attivando opportunamente i segnali emessi dalla matrice è possibile riscaldare una serie di punti sul piano X'-Z'.
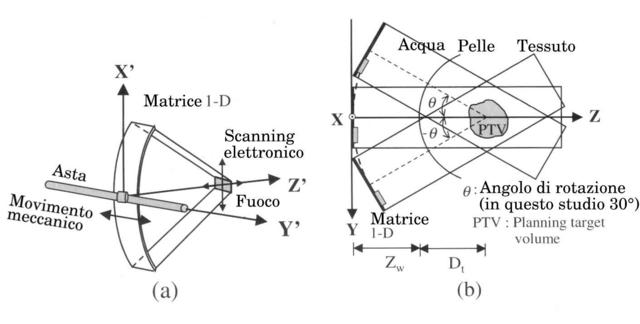
Fig. 86 Configurazione del sistema meccanico-elettronico. (a) Gli ultrasuoni emessi dalla matrice unidimensionale sono focalizzati sul piano X'-Z'. Il trasduttore è spostato lungo l'asta producendo il riscaldamento tridimensionale dell'intero volume. (b) Il sistema comprensivo dell'asta è ruotato a -30°, 0°, +30° per allargare la finestra acustica.
Per allargare la finestra acustica che trasmette la potenza, l'asta con il trasduttore è ruotata in sequenza a 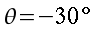 ,
, 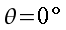 ,
, 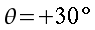 , come mostrato in Fig. 86(b). In questa maniera numerosi punti di riscaldamento sono distribuiti su tutto il volume obiettivo (PTV). Scegliendo opportunamente la potenza su questi punti è possibile modellare la forma della zona riscaldata.
, come mostrato in Fig. 86(b). In questa maniera numerosi punti di riscaldamento sono distribuiti su tutto il volume obiettivo (PTV). Scegliendo opportunamente la potenza su questi punti è possibile modellare la forma della zona riscaldata.
Per il resto della trattazione viene assunto che tutto il complesso meccanico-elettronico si trovi in una vasca d'acqua distillata e degassata, e che l'acqua riempia tutto lo spazio tra la pelle e il trasduttore.
Distribuzione dei punti focali
La distribuzione dei punti focali è mostrata in Fig. 87. In Fig. 87(a) sono visualizzati i punti rispetto ad ogni posizione del trasduttore sull'asta. I fuochi sono posti sull'asse X' a 0,5 cm l'uno dall'altro, tra la posizione X'=-2 cm e X'=+2 cm.
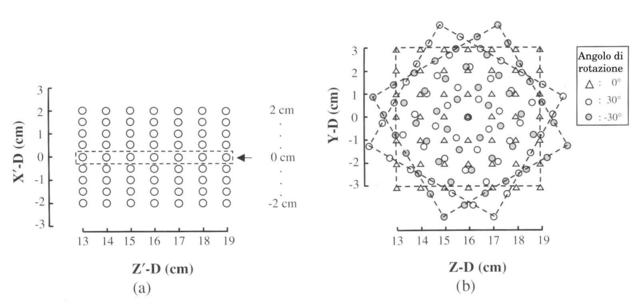
Fig. 87 Disposizione dei punti focali. (a) Ad ogni spostamento sull'asta il traduttore focalizza le onde ogni 0,5 cm sull'asse X' e ogni 1 cm sull'asse Z'. (b) Ad ogni rotazione di 30° il traduttore percorre tutto l'asse Y' ripetendo sempre lo schema esposto in (a), perciò si genera la sovrapposizione delle tre configurazioni.
Mentre sull'asse Z' i punti sono distanziati di 1 cm variano dalla posizione Z'=13 cm alla posizione Z'=19 cm.
Sull'asse Y' il trasduttore viene trasportato dalla posizione Y'=-3 cm alla posizione Y'=+3 cm, facendogli riscaldare una sezione ogni 1 cm.
Ad ogni rotazione di 30° lo strumento ripercorre l'asse Y' riscaldando nuovamente le sezioni sempre secondo lo schema di Fig. 87(a), ma da un'altra angolazione; in questo modo si ha una sovrapposizione dei punti, sezione per sezione, secondo lo schema di Fig. 87(b).
Chiaramente non tutti i punti indicati verranno effettivamente riscaldati durante il trattamento, ma solamente quelli opportunamente selezionati per conformare le dimensioni della zona da riscaldare. Inoltre la potenza erogata su ogni punto sarà calcolata da un algoritmo di ottimizzazione.
Calcolo del campo ultrasonoro
Nella trattazione seguente, senza ledere la sua generalità, verranno considerati, di tutti i punti che è possibile riscaldare secondo quanto già esposto, solo N, cioè solo quelli che servono a riscaldare un determinato volume. La potenza assorbita dal tessuto dall'i-esimo punto sarà:
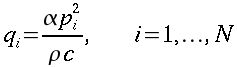 | (73) |
Indicando con 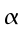 il coefficiente di assorbimento ultrasonoro del tessuto,
il coefficiente di assorbimento ultrasonoro del tessuto,  la densità del tessuto,
la densità del tessuto,  la velocità del suono nel tessuto,
la velocità del suono nel tessuto, 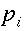 la pressione ultrasonora. I valori considerati sono elencati nella tabella Tabella 7.
la pressione ultrasonora. I valori considerati sono elencati nella tabella Tabella 7.
Il calcolo della pressione ultrasonora in ogni punto del campo si basa sulla teoria della diffrazione di Sommerfield e Rayleigh. Il calcolo del segnale che comanda l'attivazione degli elementi del trasduttore al fine di creare il campo sonoro richiesto è affidato al metodo iterativo pseudoinverso inventato dal prof. Ebbini nel 1989 [8] che risulta molto efficiente.
| Parametro del tessuto | Valore |
|---|---|
| Velocità del suono | 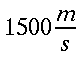 |
| Densità | 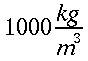 |
| Coefficiente di assorbimento ultrasonoro | 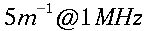 |
| Conduttività termica | 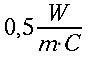 |
| Calore specifico del sangue |  |
| Perfusione sanguigna |  |
Tabella 7 Parametri usati per il campo acustico e termico.
Modello per la temperatura
Anche in questo caso verrà adoperata l'equazione di Pennes per calcolare l'innalzamento della temperatura all'interno del tessuto:
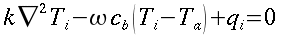 | (74) |
Il significato dei vari termini è sempre lo stesso, 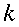 rappresenta la conduttività termica,
rappresenta la conduttività termica, 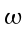 la perfusione sanguigna, e
la perfusione sanguigna, e 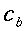 il calore specifico del sangue. I valori considerati sono espressi in Tabella 7, per semplificare l'elaborazione la perfusione e la conduttività termica sono considerate uniformi sia nel tessuto sano, sia in quello tumorale. Per calcolare il campo termico si è utilizzato una tecnica agli elementi finiti, dove la potenza depositata ottenuta dall'equazione 73, viene sostituita nella 74.
il calore specifico del sangue. I valori considerati sono espressi in Tabella 7, per semplificare l'elaborazione la perfusione e la conduttività termica sono considerate uniformi sia nel tessuto sano, sia in quello tumorale. Per calcolare il campo termico si è utilizzato una tecnica agli elementi finiti, dove la potenza depositata ottenuta dall'equazione 73, viene sostituita nella 74.
Scanning
Se la velocità del sistema meccanico è sufficientemente alta, allora è lecito considerare il funzionamento del trasduttore simile agli scanner elettronici per ecografie. Quindi la risposta di un punto del tessuto può essere vista come sovrapposizione delle diverse "scansioni" nelle varie posizioni angolari (cfr. [19]), e quindi è possibile costruire una matrice della risposta termica del tessuto:
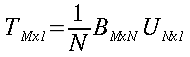 | (75) |
ovvero
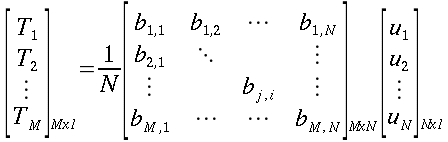
Dove 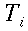 è la temperatura nel punto M del tessuto. B è la matrice che tiene conto dell'interazione tra la messa a fuoco del punto N per il trasduttore e l'innalzamento effettivo del punto M, cioè ogni elemento
è la temperatura nel punto M del tessuto. B è la matrice che tiene conto dell'interazione tra la messa a fuoco del punto N per il trasduttore e l'innalzamento effettivo del punto M, cioè ogni elemento 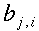 , rappresenta l'innalzamento di temperatura del punto i creato dal campo sonoro j.
, rappresenta l'innalzamento di temperatura del punto i creato dal campo sonoro j.
Ottimizzazione attraverso un modello iterativo
L'obiettivo dell'ottimizzazione è di trovare un adeguato vettore U, che rappresenta il campo ultrasonore creato dal trasduttore, da mettere nell'equazione 75, tale da creare il campo termico desiderato. La temperatura da far raggiungere al tessuto neoplastico è di 43°C in questo studio, il prof. McGough propose nel 1992 [19] un algoritmo per calcolare il campo ultrasonoro da somministrare al paziente per ottenere il campo termico desiderato. Sfortunatamente tale soluzione comporta la deposizione all'interno di alcune zone del tessuto di potenza negativa, che è ovviamente impossibile trasmettere con gli ultrasuoni. Gli ultrasuoni possono solamente riscaldare un tessuto, ma non raffreddarlo, quindi la potenza depositabile è sempre positiva o al limite nulla.
Si è pensato di approssimare la funzione ottenuta con il metodo di McGough attraverso un metodo iterativo tale da eliminare i termini negativi, ottenendo un campo ultrasonoro molto simile a quello originale. A tale scopo si introduce una funzione di rischio J:
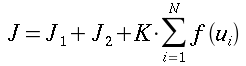 | (76) |
dove
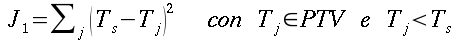
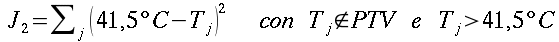
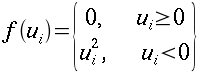
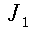 è il rischio di avere dei punti all'interno del tumore (PTV) con temperatura inferiore a quella controllo17, che non è effettivamente quella richiesta (43°C) ma quella necessaria per ottenere la dimensione voluta della zona da riscaldare.
è il rischio di avere dei punti all'interno del tumore (PTV) con temperatura inferiore a quella controllo17, che non è effettivamente quella richiesta (43°C) ma quella necessaria per ottenere la dimensione voluta della zona da riscaldare. 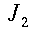 È il rischio che le temperature all'esterno della zona da trattare superino 41,5°C, poiché è stata considerata questa temperatura il limite che divide un tessuto trattato con ipertermia da uno non trattato, in modo da prevenire dei danni ai tessuti sani.
È il rischio che le temperature all'esterno della zona da trattare superino 41,5°C, poiché è stata considerata questa temperatura il limite che divide un tessuto trattato con ipertermia da uno non trattato, in modo da prevenire dei danni ai tessuti sani. 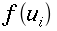 è un termine che aggrava la funzione di rischio forzando però la
è un termine che aggrava la funzione di rischio forzando però la 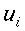 risultante ad essere positiva; mentre se
risultante ad essere positiva; mentre se 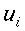 è positiva, non c'è necessitò della
è positiva, non c'è necessitò della 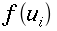 , che perciò diviene nulla.
, che perciò diviene nulla. 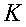 è una costante che enfatizza la penalità introdotta da
è una costante che enfatizza la penalità introdotta da 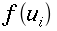 , un valore che esalti sufficientemente la penalità senza renderla dominante nella funzione di rischio è 1000.
, un valore che esalti sufficientemente la penalità senza renderla dominante nella funzione di rischio è 1000.L'algoritmo iterativo per trovare il valore ottimale è il seguente:
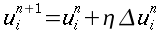 | (77) |
con
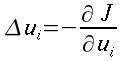
dove l'apice  rappresenta il numero dell'iterazione. La stima
rappresenta il numero dell'iterazione. La stima 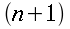 -esima è valutata dalla stima del n-esima iterazione incrementata del prodotto
-esima è valutata dalla stima del n-esima iterazione incrementata del prodotto 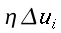 .
. 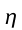 è una costante utilizzata per decidere il passo dell'iterazione e vale
è una costante utilizzata per decidere il passo dell'iterazione e vale 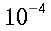 . Nei casi presentati in questo studio sono stati necessari dalle 2000 alle 4000 iterazioni. Alla fine di ogni ciclo d'iterazione, nella soluzione finale, sono rimasti pochissime soluzioni negative, queste sono state trascurate e portate a zero senza aver osservato cambiamenti significativi.
. Nei casi presentati in questo studio sono stati necessari dalle 2000 alle 4000 iterazioni. Alla fine di ogni ciclo d'iterazione, nella soluzione finale, sono rimasti pochissime soluzioni negative, queste sono state trascurate e portate a zero senza aver osservato cambiamenti significativi.
Risultati
Il baricentro del tessuto da trattare (PTV) è localizzato a 8 cm di profondità dall'interfaccia acqua-pelle 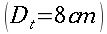 , l'interfaccia a sua volta si trova a 8 cm
, l'interfaccia a sua volta si trova a 8 cm 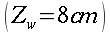 dal centro del trasduttore, come mostrato in Fig. 86(b). Il trasduttore consiste di 64 elementi, ognuno alto 3 mm e largo 20 mm, ottenendo così un arco lungo 192 mm, per evitare interferenza di natura costruttiva, l'arco ha un raggio di curvatura di 18 cm.
dal centro del trasduttore, come mostrato in Fig. 86(b). Il trasduttore consiste di 64 elementi, ognuno alto 3 mm e largo 20 mm, ottenendo così un arco lungo 192 mm, per evitare interferenza di natura costruttiva, l'arco ha un raggio di curvatura di 18 cm.
Riscaldando un volume cilindrico
In questa simulazione il tessuto tumorale ha un raggio di 2 cm e un'altezza di 4 cm, la perfusione sanguigna è considerata costante e pari a 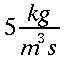 . Il primo passo nella simulazione è di scegliere i punti focali corretti, a tal fine ci viene in aiuto lo studio del prof. Ocheltree [23] in cui indica che la potenza deposta necessaria per la cura dei tumori può essere divisa attraverso tre regioni: quella all'esterno del tumore, dove non c'è necessità di depositare potenza, all'interno del tumore, dove la potenza deve essere equivalente a quella in uscita dovuta alla perfusione, in modo da mantenere costante la temperatura, e la regione di confine fra le due precedenti, dove vi è la necessità di maggiore potenza a causa della maggiore conduttività termica lungo il contorno del tumore. I punti scelti sono esposti in Fig. 88, solamente in cinque strati è stato fatto il trattamento (X=0, ±1, ±2cm).
. Il primo passo nella simulazione è di scegliere i punti focali corretti, a tal fine ci viene in aiuto lo studio del prof. Ocheltree [23] in cui indica che la potenza deposta necessaria per la cura dei tumori può essere divisa attraverso tre regioni: quella all'esterno del tumore, dove non c'è necessità di depositare potenza, all'interno del tumore, dove la potenza deve essere equivalente a quella in uscita dovuta alla perfusione, in modo da mantenere costante la temperatura, e la regione di confine fra le due precedenti, dove vi è la necessità di maggiore potenza a causa della maggiore conduttività termica lungo il contorno del tumore. I punti scelti sono esposti in Fig. 88, solamente in cinque strati è stato fatto il trattamento (X=0, ±1, ±2cm).
Fig. 88 Punti focali selezionati per il trattamento di un tumore cilindrico di 2cm di raggio e 4 cm di altezza.
La distribuzione del campo di temperatura risultante ponendo  è mostrata in Fig. 89. La Fig. 89(a) raffigura la superficie isoterma a 43°C, mentre le Fig. 89(b, c, d) visualizzano i contorni nei piani rispettivamente X=0cm, Y=0cm, Z=16cm. Si vede chiaramente che tutta la zona da trattare ha raggiunto i 43°C, ma anche che alcune parti di tessuto sano sono state danneggiate. Quest'ultimo effetto è dovuto al fatto che benché i punti focali sia piccoli, circa 2 mm, la distanza fra l'uno e l'altro in una data posizione del trasduttore è molto più grande, circa 1 cm. Tra la pelle e la zona da trattare o sulla pelle stessa non si sono osservate zone surriscaldate eccessivamente.
è mostrata in Fig. 89. La Fig. 89(a) raffigura la superficie isoterma a 43°C, mentre le Fig. 89(b, c, d) visualizzano i contorni nei piani rispettivamente X=0cm, Y=0cm, Z=16cm. Si vede chiaramente che tutta la zona da trattare ha raggiunto i 43°C, ma anche che alcune parti di tessuto sano sono state danneggiate. Quest'ultimo effetto è dovuto al fatto che benché i punti focali sia piccoli, circa 2 mm, la distanza fra l'uno e l'altro in una data posizione del trasduttore è molto più grande, circa 1 cm. Tra la pelle e la zona da trattare o sulla pelle stessa non si sono osservate zone surriscaldate eccessivamente.
Fig. 89 Mappe termiche del tessuto tumorale riscaldato. La linea tratteggiata rappresenta la zona da trattare. (a) Superficie isotermica a 43°C. (b) Sezione a X=0cm. (c) Sezione a Y=0cm. (d) Sezione a Z=16cm.
Per valutare la bontà del trattamento introduciamo gli indici CI e EI. L'indice CI, chiamato indice di convergenza, rappresenta la frazione di volume obiettivo (PTV) ad una temperatura superiore di quella prescelta nella valutazione, la cui formula è:
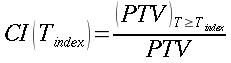
analogamente EI rappresenta il rapporto tra il volume esterno al tumore (NPTV) elevato ad una temperatura maggiore di quella scelta nella valutazione:
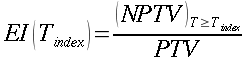
La Fig. 90 a sinistra mostra CI e EI in funzione della temperatura 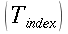 per il tumore di forma cilindrica. Entrambi decrescono con l'aumentare della temperatura di riferimento; scegliendo
per il tumore di forma cilindrica. Entrambi decrescono con l'aumentare della temperatura di riferimento; scegliendo 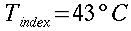 , al di sopra di tale temperatura si trova il 95,3% del tumore e solo il 10,5% del tessuto sano riscaldato. Una percentuale così alta oltre i 43°C non deve spaventare, è vero che all'inizio di questo capitolo è stato scritto che una temperatura superiore ai 43°C è sconsigliata, ma se si osserva meglio la scala delle ascisse del diagramma di CI, si nota che meno del 3% del tessuto tumorale raggiunge i 44°C; quindi la curva CI denota solamente una certa stabilità della temperatura raggiunta e un'adeguata uniformità.
, al di sopra di tale temperatura si trova il 95,3% del tumore e solo il 10,5% del tessuto sano riscaldato. Una percentuale così alta oltre i 43°C non deve spaventare, è vero che all'inizio di questo capitolo è stato scritto che una temperatura superiore ai 43°C è sconsigliata, ma se si osserva meglio la scala delle ascisse del diagramma di CI, si nota che meno del 3% del tessuto tumorale raggiunge i 44°C; quindi la curva CI denota solamente una certa stabilità della temperatura raggiunta e un'adeguata uniformità.
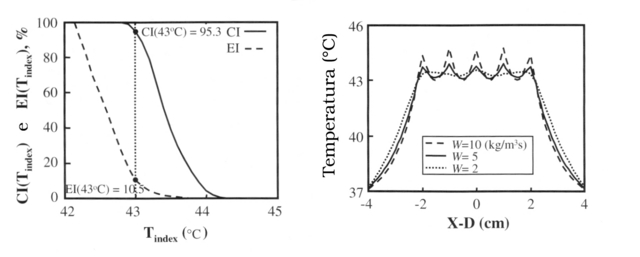
Fig. 90 A sinistra: CI e EI in funzione della temperatura. A destra: Distribuzione di temperatura sull'asse del tumore per differenti valori della perfusione sanguigna.
Variazioni della perfusione sanguigna possono determinare cambiamenti sostanziali nella distribuzione della temperatura. La Fig. 90 a sinistra mette in evidenza la temperatura lungo l'asse centrale del tumore con diversi valori della perfusione. Con piccoli valori della perfusione 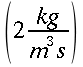 l'andamento della curva è dolce e uniforme, mentre per valori più alti
l'andamento della curva è dolce e uniforme, mentre per valori più alti 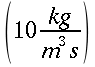 la distribuzione diviene irregolare ma comunque i valori più bassi raggiungono comunque i 43°C.
la distribuzione diviene irregolare ma comunque i valori più bassi raggiungono comunque i 43°C.
Correlazione tra la risposta e la durata impulso
La Fig. 91 espone la distribuzione di temperatura nel tessuto per tre durate dell'impulso differente, cioè per tre casi in cui varia il tempo necessario a scaldare un punto focale.
Fig. 91 Risposte correlate ad una determinata durata dell'impulso nella sezione X=0 cm. (a) Impulso di durata 0,2s. (b) Impulso di durata 0,5s. (c) Impulso di durata 1s. (d) Temperatura massima e minima al centro del tumore e sulla superficie, al variare dell'impulso.
Una diminuzione della durata dell'impulso, implica un aumento della velocità di scannerizzazione di un'intera sezione, e in ultima analisi del riscaldamento di tutto il tumore. Come era prevedibile, più breve è la durata dell'impulso, maggiore è la precisione con cui si riesce a controllare la zona, poiché intercorre un tempo minore tra una scannerizzazione e la successiva della stessa sezione.
La Fig. 91(d) mostra le fluttuazioni del centro del tumore, punto A di coordinate (X,Y,Z)=(0,0,16), e di un punto sulla superficie, punto B (X,Y,Z)=(2,0,16); le fluttuazioni di B sono maggiori a causa della maggiore conducibilità termica.
Effetti della variazione della temperatura di controllo
E' stato affermato precedentemente che la temperatura di controllo 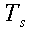 , utilizzata nel calcolo della funzione di rischio (cfr. eq. 76), permette di variare il volume del tessuto riscaldato, poiché non tutto il tessuto tumorale supera, nel calcolo del CI, i 43°C è lecito chiedersi se variando
, utilizzata nel calcolo della funzione di rischio (cfr. eq. 76), permette di variare il volume del tessuto riscaldato, poiché non tutto il tessuto tumorale supera, nel calcolo del CI, i 43°C è lecito chiedersi se variando 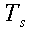 se è possibile far superare i 43°C a tutto il tumore. La Fig. 92 risponde a tale quesito: si nota che CI cresce molto più velocemente di EI, quindi è possibile riscaldare tutto il tumore a 43°C senza un eccessivo danno ai tessuti sani.
se è possibile far superare i 43°C a tutto il tumore. La Fig. 92 risponde a tale quesito: si nota che CI cresce molto più velocemente di EI, quindi è possibile riscaldare tutto il tumore a 43°C senza un eccessivo danno ai tessuti sani.
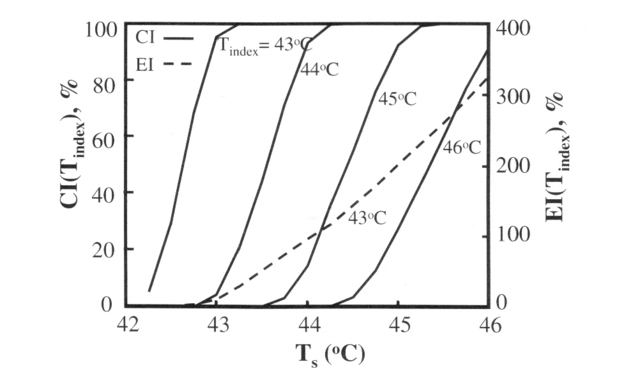
Fig. 92 Andamenti di CI e EI per diversi valori della temperatura di controllo. Tutte le rimanenti condizioni non sono state modificate.
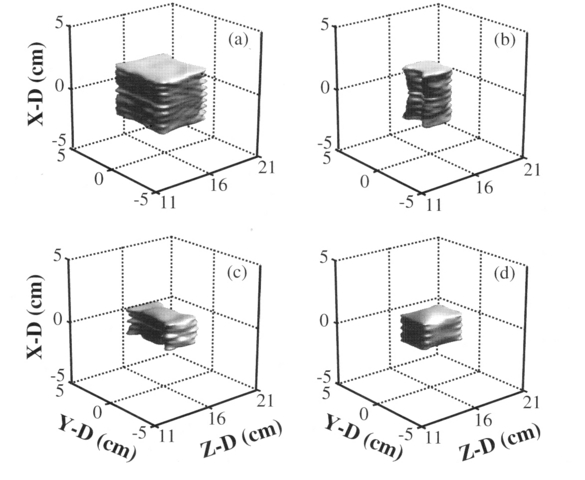
Fig. 93 Superfici isoterme a 43°C per diverse forme del tumore.
La temperatura di controllo necessaria a portare tutto il tumore a 43°C è  , però è anche vero che la percentuale di tumore che supera i 44°C è superiore al 10%, quindi spetta al medico decidere, a seconda della grandezza del tumore se scegliere o no tale campo di temperatura. Se invece l'obiettivo è di non danneggiare assolutamente alcun tessuto sano,
, però è anche vero che la percentuale di tumore che supera i 44°C è superiore al 10%, quindi spetta al medico decidere, a seconda della grandezza del tumore se scegliere o no tale campo di temperatura. Se invece l'obiettivo è di non danneggiare assolutamente alcun tessuto sano,  deve valere 42,5°C; così facendo
deve valere 42,5°C; così facendo 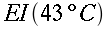 va a zero, ma anche CI scende al 30% rendendo il trattamento quasi inefficace.
va a zero, ma anche CI scende al 30% rendendo il trattamento quasi inefficace.
Altre forme possibili per il volume da riscaldare
Per testare la flessibilità dello scanner a matrice, si è provato a scaldare altre forme geometriche del tessuto tumorale. I risultati sono visualizzati in Fig. 93, ogni superficie tracciata rappresenta un'isoterma a 43°C. Le forme geometriche prescelte hanno le seguenti dimensioni: (a) 4x4x4 cm, (b) 4x2x2 cm, (c) 2x4x2 cm, (d) 2x2x4 cm. I valori quantitativi sono esposti nella Tabella 8, si vede che generalmente si ottiene un valore del CI attorno al 95% e un EI sempre inferiore al 25%. Questi valori sono molto buoni ma se confrontiamo anche la temperatura massima notiamo che il volume (d) ha una temperatura massima di ben 48°C, sintomo di un'instabilità termica, e ciò è inaccettabile. Si capisce quindi che per un tumore eccessivamente "stretto" lungo Y il metodo iterativo è un'approssimazione troppo grossolana, ma per tutti gli altri casi risulta estremamente soddisfacente.
| Volume(cm) | Perfusione 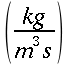 | Impulsi per ciclo | Sezioni |  |  | 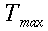 (°C) (°C) | 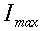  |
|---|---|---|---|---|---|---|---|
| Cilindr.R=2, h=4 | 2 | 81 | 5 | 95,7% | 5,1% | 44,0 | 153 |
| ? | 5 | 81 | 5 | 95,3% | 10,5% | 44,5 | 269 |
| ? | 10 | 83 | 5 | 95,8% | 21,5% | 44,8 | 602 |
| 4x4x4 | 5 | 92 | 9 | 95,4% | 11,6% | 44,7 | 310 |
| 4x2x2 | 5 | 37 | 9 | 94,3% | 23,0% | 44,0 | 172 |
| 2x4x2 | 5 | 62 | 5 | 92,4% | 15,8% | 44,4 | 183 |
| 2x2x4 | 5 | 35 | 5 | 95,1% | 15,7% | 48,3 | 122 |
Tabella 8 Parametri utilizzati nei diversi volumi e conseguenti risultati.
Discussione dei risultati
La simulazione esposta dimostra come sia possibile praticare l'ipertermia con gli ultrasuoni. La macchina, per superare il limiti costruttivi riguardo la dimensione del trasduttore, opera più cicli in sequenza sulla neoplasia da trattare. La temperatura ottenuta e mantenuta da questo tipo di applicazione rientra nei limiti imposti dal trattamento clinico, cioè una temperatura tra i 42°C e i 43°C.
A causa della potenza trasferita potrebbero evidenziarsi delle forme di cavitazione acustica nel tessuto, studi sperimentali compiuti nel 1991 [15] suggeriscono come potenza massima  a 1 MHz per evitare imprevedibili effetti di cavitazione. Dalla Tabella 8 si vede come la potenza massima utilizzata sia
a 1 MHz per evitare imprevedibili effetti di cavitazione. Dalla Tabella 8 si vede come la potenza massima utilizzata sia  con un valore di perfusione sanguigna pari a
con un valore di perfusione sanguigna pari a 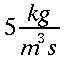 , ma anche prendendo un valore molto alto di perfusione,
, ma anche prendendo un valore molto alto di perfusione, 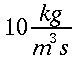 , il valore della potenza trasferita nel tessuto è pari a
, il valore della potenza trasferita nel tessuto è pari a 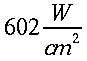 , in altre parole si è lontani dal pericolo di cavitazione.
, in altre parole si è lontani dal pericolo di cavitazione.
Un altro fattore da considerare è la fluttuazione della temperatura tra una scansione e la successiva della medesima sezione, l'ultimo studi al riguardo compiuto dal prof. Moros afferma che il tempo massimo per eseguire un'intera scansione non deve superare i 10 s. Nella simulazione sul volume di forma circola, utilizzando un impulso di durata di 0,2 s e producendo 81 campi ultrasonori, sono necessari circa 16 s per una ciclo completo; però la variazione di temperatura tra un ciclo e il successivo è di 1°C, mentre nello studio del prof. Morons il tempo era correlato ad una variazione di temperatura di 1,5°C, perciò si può ritenere accettabile il tempo impiegato in questa simulazione.
Molti studi sull'ipertermia [4, 11, 12] indicano che per ottenere i migliori risultati è necessario avere una distribuzione di temperatura uniforme nella neoplasia. Il parametro decisivo per l'uniformità della temperatura in questo tipo di trattamento è la perfusione sanguigna (v. Fig. 90 a destra). Durante il trattamento, il meccanismo di regolazione della temperatura dell'organismo tende ad aumentare la perfusione per smaltire l'eccesso di calore nella zona trattata; però è anche vero che nei tumori la perfusione tende a diminuire all'aumentare della temperatura. Per questo motivo sono stati eseguiti dei test in due casi estremi con bassa e alta perfusione  . In entrambi i casi si è arrivati a riscaldare più del 95% del tumore alla temperatura richiesta (v. Tabella 8), chiaramente la potenza necessaria per riscaldare il tumore, nel caso dell'alta perfusione, è quasi il doppio di quella normale.
. In entrambi i casi si è arrivati a riscaldare più del 95% del tumore alla temperatura richiesta (v. Tabella 8), chiaramente la potenza necessaria per riscaldare il tumore, nel caso dell'alta perfusione, è quasi il doppio di quella normale.
La costanza della perfusione nel tempo non è un'ipotesi troppo forte, ma degli studi in proposito [10] affermano che a causa della crescita irregolare e incontrollata dei tumori, la perfusione all'interno di essi varia di molto da punto a punto. La tendenza all'interno di un tessuto neoplastico, è di avere un centro necrotico con una perfusione molto bassa, e, viceversa, una periferia con un'elevata perfusione. Per questo motivo è stata eseguita un'ulteriore simulazione, i cui risultati sono esposti in Fig. 94. Il tessuto neoplastico, in quest'ultima simulazione, è un cilindro avente diametro e altezza entrambi pari a 4 cm, diviso in tre zone: la perfusione della periferia al centro è presa pari rispettivamente a  . Il riscaldamento si è ottenuto con il utilizzando nove sezioni, X=0 cm, X=±0,5 cm, X=±1 cm, X=±1,5 cm, X=±2 cm come mostra la Fig. 88(a). I risultati mostrano che c'è necessità di maggiore potenza per riscaldare il tessuto neoplastico, e che la parte di tessuto sano trattata è maggiore del caso con perfusione uniforme.
. Il riscaldamento si è ottenuto con il utilizzando nove sezioni, X=0 cm, X=±0,5 cm, X=±1 cm, X=±1,5 cm, X=±2 cm come mostra la Fig. 88(a). I risultati mostrano che c'è necessità di maggiore potenza per riscaldare il tessuto neoplastico, e che la parte di tessuto sano trattata è maggiore del caso con perfusione uniforme.
In conclusione si può affermare che questo metodo provvede un accettabile tecnica ipertermica, in cui l'unico caso mostrato d'instabilità termica, un eccessivo sviluppo longitudinale lungo l'asse ortogonale a Y, può essere brillantemente superato adagiando il paziente in maniera opportunamente il paziente all'interno del macchinario.
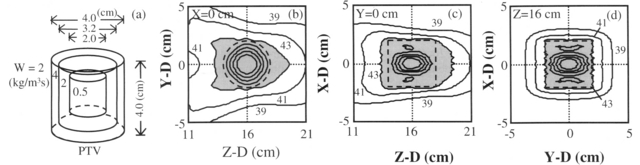
Fig. 94 Risultati della simulazione del riscaldamento di un tessuto neoplastico con perfusione sanguigna non uniforme. La linea tratteggiata rappresenta il contorno del tessuto neoplastico, la zona in grigio parte del tessuto con temperatura superiore a 43°C.
Bibliografia
- [1] Pontiggia, 1998, Quel calore che cura i tumori.
- [2] Bornstein e Zouranjian et al., 1993, Local hyperthermia, radiation therapy and chemotherapy in patients with local-regional recurrence of breast carcinoma, Int. J. Radiat. Oncol. Biol. Phys., 25, 79-85.
- [3] Das e Clegg et al., 1999, Computational technique for fast hyperthermia temperature optimization, Med. Phys., 2, 319-328.
- [4] Diederich e Hopwood et al., 1999, Ultrasound technology for hyperthermia, Ultrasound Med. Biol., 25, 871-886.
- [5] Duck, 1990, Physical properties of tissue.
- [6] Ebbini e Cain, 1988, A cylindrical-section ultrasound phased-array applicator for hyperthermia cancer therapy, IEEE Trans. Ultraso. Ferroelectr. Freq. Control., 35, 561-572
- [7] Ebbini e Cain, 1989, Multi-focus ultrasound phased-array pattern synthesis: optimal driving-signal distributions for hyperthermia, IEEE Trans. Ultraso. Ferroelectr. Freq. Control., 36, 540-548.
- [8] Ebbini e Cain, 1991, A spherical-section ultrasound phased array applicator for deep localized hyperthermia, IEEE Trans. Biomed. Eng, 38, 634-643.
- [9] Endrich e Reinhold et al., 1979, Tissue perfusion inhomogenity during early tumor growth in rats.
- [10] Fajardo, 1984, Pathological effects of hyperthermia in normal tissue, Cancer Res. (Suppl.), 44, 4826s-4835s.
- [11] Field e Hume, 1977, The response of tissue to combined hyperthermia and x-rays, Br. J. Radiol., 50, 129-134.
- [12] Gotterfield e Weisman, 1973, Introduction to Optimization theory, Englewood.
- [13] Hand e Vernon et al., 1992, Early experience of a commercial scanned focused ultrasound hyperthermia system, Int. J. Hyperth., 8, 587-607.
- [14] Hynynen, 1991, The treshold for thermally significant cavitation in dog's thigh muscle in vivo, Ultrasound Med. Biol., 17, 157-169.
- [15] Hynynen e Roemer et al., 1987, A scanned, focused, multiple trasducer ultrasonic system for localized hyperthermia treatments, Int. J. Hyperth., 3, 21-35.
- [16] Ibbini e Cain, 1990, The concentric-ring array for ultrasound hyperthermia: combined mechanical and electrical scanning, Int. J. Hyperth., 6, 401-419.
- [17] Lin e Yen et al., 1999, Relationship between acoustic aperture size and tumor condition for extrernal ultrsound hyperthermia, Med. Phys., 26, 818-824.
- [18] McGough e Ebbini et al., 1992, Direct computation of ultrasound phased-array driving signals from specified temperature distribution for hyperthermia, IEEE Trans. Biomed. Eng., 39, 825-835.
- [19] McGough e Wang et al., 1994, Mode scanning: heating pattern synthesis with ultrasound focused array, Int. J. Hyperth., 10, 433-442.
- [20] Moros e Roemer, 1988, Simulation of scanned focused ultrasound hyperthermia: the effects of scanning speed and pattern on the temperature fluctuations at the focal depth, IEEE Trans. Ultrasound Ferroelectr. Freq. Control, 35, 552-559.
- [21] Nikita e Maratos et al., 1993, Optimal steady-state temperature distribution for a phased array hyperthermia system, IEEE Trans. Biomed. Eng., 40, 1299-1306.
- [22] Ocheltree e Frizzell, 1987, Determination of power deposition patterns for localized hyperthermia: steady-state analysis, Int. J. Hyperth., 3, 269-276.
- [23] Ocheltrre e Frizzel, 1988, Determination of power deposition patterns for localized hyperthermia: transient analysis, Int. J. Hyperth., 4, 281-296.
- [24] Overgaard, 1989, The current e potential role of hyperthermia in radiotherapy, Int. J. Radiat. Oncol. Biol. Phys., 16, 537-549.
- [25] Saw, 1988, Reference does rate for single e double-plane implants, Med. Phys., 15, 391-395.
- [26] Song e Choi et al, 1995, Microvasculature and perfusion in normal tissue and tumors, Thermalradiotherapy and Thermalchemoterapy, vol.1, 139-156, New York.
- [27] Umemura e Cain, 1989, The sector vortex phased array: acoustic field synthesis for hyperthermia, IEEE Trans. Ultrasound Ferroelectric. Freq. Control, 36, 249-257.
- [28] Van der Zee e Gonalez et al., 2000, Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours: a prospective, randomised, multicentre trial, 355, 119-1125.
- [29] Kuen-Cheng e Yuong-Yaw et al., 2003, One dimensional phased array with mechanical motion for conformal ultrasound hyperthermia.
Conclusione
Questo lavoro vuole essere un'analisi sulla trasmissione del calore nei tessuti biologici umani, atto a comprendere meglio come oggi sono progettati gli strumenti e le applicazioni che si interfacciano con essa.
Lo studio fatto è stato redatto con lo scopo di fornire una base valida alla progettazione e al potenziamento degli strumenti esistenti; tali strumenti, di natura prettamente clinica, potranno migliorare sempre più la qualità della vita.
Nell'analisi fatta, si sono voluti mostrare i risultati ottenuti nella realizzazione di modelli matematici, creati per simulare la risposta fisiologica dell'organismo senza dover ricorrere a sperimenti in vivo. Altresì sono stati effettuati degli esperimenti su dei campioni di tessuto dove esistessero incertezze sulla validità del modello matematico. In entrambi i casi si sono evidenziati i pregi e i difetti di ciascuna metodologia.
Poiché tutte le relazioni matematiche proposte fanno capo all'equazione di Pennes, si è scelto di analizzare a fondo tale equazione, mostrando sia com'è stata ottenuta, sia tutte le critiche che i miglioramenti che sono stati apportati ad essa nel passare degli anni, fino ad oggi.
L'equazione di Pennes non ha valore solo nell'ambito clinico, e per questo sono state presentati progetti riguardanti aspetti diversi dell'ingegneria, quale ad esempio la progettazione d'abiti ignifughi.
La maggior parte delle metodologie presentate riguarda la chirurgia non invasiva o il trattamento dei tumori in maniera non invasiva. I più grandi miglioramenti che l'ingegneria clinica italiana può apportare è proprio in questo campo, poiché tali ricerche non necessitano di grandi finanziamenti. Durante le ricerche effettuate per la stesura di quest'opera si è riscontrato che in altri paesi all'avanguardia in questo campo, come gli U.S.A. o Israele, si spendono migliaia di dollari per la progettazione di macchine terapeutiche che in Italia sarebbero impensabili, come accoppiare una macchina per la risonanza magnetica con una per il trattamento ipertermico agli ultrasuoni. Mentre la realizzazione d'apparecchiature non invasive, oltre a non richiedere grandi risorse finanziarie, permette una commercializzazione e un ritorno dei costi in tempi brevi.
Nella trattazione non si è escluso il punto di vista del paziente, evidenziando sempre la fattibilità dei progetti in termini di dolore, lesioni permanenti ed anche del costo dei trattamenti proposti.
Si spera che le metodologie future richiedano sempre minori traumi e un minor tempo di riabilitazione e, non ultimo, una riduzione dei costi connessi all'operazione chirurgica e al tempo di degenza.
Note
1Questo valore della velocità dell'aria, per un braccio umano, fornisce un valore del numero di Reynolds pari a 20, cioè risulta impercettibile il movimento dell'aria.
2Per equazione di Bessel si intende un equazione differenziale del tipo:
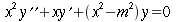
dividendo questa equazione per x2 si immette la singolarità x=0, ma si può applicare la soluzione per sviluppo in serie:
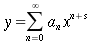
dove s è un coefficiente generalizzato, sostituendo nell'equazione differenziale abbiamo:
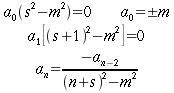
in questo modo la soluzione diventa:
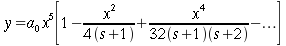
3La funzione di Bessel J è così definita:
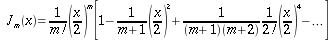
4Per chiarezza vengono riportati significati:
- densità
- k conduttività termica
- T temperatura
- t tempo
il pedice "t" indica i tessuti ed il pedice "b" il sangue.
5A destra dell'uguaglianza l'equazione si può scrivere in questa forma:
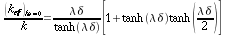
che mostra la dipendenza di 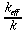 da
da 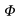 e da
e da 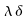 solamente, ma è meno utile per mostrare l'importanza della produzione di calore metabolico.
solamente, ma è meno utile per mostrare l'importanza della produzione di calore metabolico.
6I simboli dell'equazione 55 sono leggermente diversi dal resto della trattazione per evitare fraintendimenti con l'introduzione dei coefficienti adimensionali nelle prossime pagine.
7Thermal infrared(IR) imaging
8Per crescita si intende l'aspetto dei punti massimi di temperatura sezione dopo sezione. Si usa questo termine perché i pixel bianchi, cioè i punti che possiedono la temperatura più alta, sezione dopo sezione occupano una area sempre maggiore.
9United States Patent N. 6,023,637,2000
10Termine un pò infelice per tradurre "cryoheater".
11Tali studi sono nell'ambito di software in grado di progettare e giudicare autonomamente nuovi approcci a lavori già compiuti su un'applicazione. Questi modelli sono chiamati LearnIT.
12Il modello di Arrhenius viene utilizzato per stabilire l'evoluzione di un processo, secondo la formula 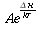 dove
dove 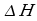 è l'energia di attivazione del processo, k la costante di Boltzmann e T la temperatura in Kelvin.
è l'energia di attivazione del processo, k la costante di Boltzmann e T la temperatura in Kelvin.
13In greco significa:"caduta delle foglie d'autunno"
14Bacillo Calmette-Guérin
15Altri medicinali utilizzati sono: Mephalan, Bleamicina, Adriamicina, Mitocina C, Nitrosuree.
16In Giappone esistono più di 200 centri che praticano l'ipertermia.
17In inglese viene indicata come "setting temperature".
Ringraziamenti
Ringrazio per l'aiuto offerto
- Prof. Paolo Pontiggia presso la clinica Città di Pavia
- Dott. Rolando direttore della ASSIE
Associazione Europea Ipertermia - Ing. Federico Torre
- La Sincrotherm s.r.l. di Vigevano
Numero di volte che e' stata consultata questa opera:


